En alliant techniques enzymatique et chimique, des scientifiques ont mis au point une méthode innovante pour produire des molécules d’ADN synthétiques. Cette nouvelle approche ouvre de nombreuses perspectives, notamment pour la production de molécules de grande taille pouvant être utilisées pour de futures thérapies.
L’ADN contenu dans nos cellules est la molécule porteuse de l’information génétique ainsi que le principal support de l’hérédité. Elle est constituée de nucléotides, elles-mêmes composées de quatre bases nucléiques, les briques élémentaires de l’ADN : l’adénine (A), la cytosine (C), la guanine (G) et la thymine (T). Le génome humain contient environ 3 milliards de ces lettres, formant en quelque sorte un livre contenant les informations essentielles au fonctionnement de notre organisme.
Outre son rôle central dans le développement et le fonctionnement des êtres vivants, l’ADN est utilisé dans des contextes extrêmement variés. Sa remarquable stabilité, permet par exemple aux scientifiques de retracer l’histoire évolutive de l’espèce humaine. Cette caractéristique permet également d’envisager l’utilisation de cette molécule comme support pour le stockage de données numériques à long terme, les quatre bases nucléiques (A,T,C,G) constituant l’ADN pouvant se substituer au code binaire utilisé jusqu’à présent. Dans un tout autre domaine, plusieurs projets sont en développement afin de mettre au point des outils diagnostiques, reposant sur de courtes séquences d’ADN synthétiques, permettant de mieux détecter diverses maladies, comme le paludisme par exemple.
ADN, ARNm, miARN : des thérapies en plein essor... mais qui présentent des limites
Depuis quelques années, plusieurs applications thérapeutiques basées sur les acides nucléiques – ADN, ARN messager (ARNm), micro-ARN (miARN) – commencent également à émerger. L’exemple le plus emblématique de ces nouveaux médicaments est le vaccin ARNm contre le SARS-CoV-2 qui a été utilisé à très large échelle lors de la pandémie de Covid-19. Toutefois, si de premiers médicaments commencent à apparaître, la production de ces molécules thérapeutiques demeure délicate. Les modifications chimiques indispensables à leur bon fonctionnement dans l’organisme rendent leur synthèse plus complexe. À titre d’exemple, la production d’ADN thérapeutiques de plus de 100 nucléotides s’avère extrêmement difficile avec les méthodes actuelles, limitant ainsi les possibilités médicamenteuses.
La découverte des micro-ARN récompensée par le prix Nobel 2024Le 7 octobre 2024, Victor Ambros et Gary Ruvkun se voyaient décerner le prix Nobel de médecine et physiologie pour leur « découverte des micro-ARN et leur rôle dans la régulation post-transcriptionnelle des gènes ». Les miARN sont des séquences d’ARN d’une vingtaine de nucléotides qui régulent l’expression d’environ la moitié des gènes chez l’être humain. Malgré des essais cliniques jusqu’à présent infructueux, ces courts fragments d’ARN représentent des pistes thérapeutiques prometteuses pour le traitement de certains cancers, les maladies cardiovasculaires ou neurodégénératives notamment. « Ces dernières années, de gros progrès ont été effectués dans le conditionnement et la modification des molécules d’ARN, permettant de les utiliser à plus petite dose et de manière plus ciblée », indique Marcel Hollenstein. Des avancées qui pourraient déboucher à moyen terme sur de premiers médicaments à base de miARN. |
Des ADN modifiés plus longs pour de nouvelles possibilités thérapeutiques
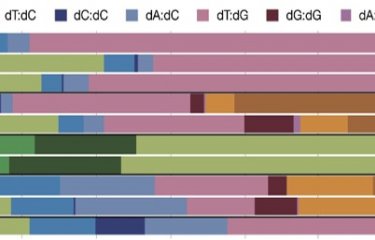
Pour outrepasser ces limites, des scientifiques de l’Institut Pasteur, de l’université Paris Cité, du CNRS et de l’entreprise pharmaceutique Roche ont réussi à mettre au point une méthode innovante mêlant techniques chimiques et enzymatiques.
« Il s’agit d’une nouvelle approche qui permet de diminuer les limites actuelles dans la production d’ADN thérapeutiques modifiés. Nous utilisons des enzymes appelées ligases plutôt que seulement des approches chimiques et nous démontrons que cette approche est compatible avec des séquences courtes, une vingtaine de nucléotides, mais également plus longues, jusqu’à 120 nucléotides », explique Marcel Hollenstein, responsable de l’unité Chimie bioorganique des acides nucléiques à l’Institut Pasteur. Pour reprendre l’analogie entre le livre et le génome, cette nouvelle méthode ouvre la possibilité de produire des phrases (des séquences longues de 120 nucléotides) là où précédemment il était possible de ne produire que des mots (des séquences de quelques dizaines de nucléotides) à visée thérapeutique.
Cette nouvelle méthode ouvre de nombreuses perspectives dans le domaine des acides nucléiques thérapeutiques mais aussi plus largement pour les applications biotechnologiques nécessitant la production de longues séquences d’ADN modifiés.
Template-dependent DNA ligation for the synthesis of modified oligonucleotides, Nature communications, 13 septembre 2024
Nazarii Sabat1, Andreas Stämpfli2, Steven Hanlon3, Serena Bisagni3, Filippo Sladojevich2, Kurt Püntener3 & Marcel Hollenstein1
1Institut Pasteur, Université Paris Cité, CNRS UMR3523, Department of Structural Biology and Chemistry, Laboratory for Bioorganic Chemistry of Nucleic Acids, 28, rue du Docteur Roux, 75724 Paris, Cedex 15, France.
2Pharma Research and Early Development, Roche Innovation Center Basel, F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, Basel, Switzerland.
3Pharmaceutical Division, Synthetic Molecules Technical Development, F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, Basel, Switzerland