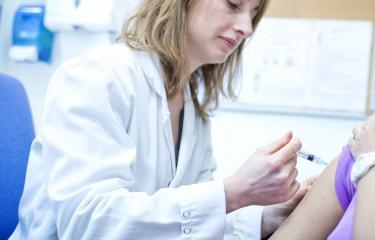
Les résultats d'un essai clinique visant à évaluer l'efficacité d'un vaccin oral contre Shigella dysenteriae sérotype 1, bactérie responsable de la forme épidémique de la shigellose ou dysenterie bacillaire, une maladie diarrhéique grave et souvent meurtrière, viennent d'être publiés dans la revue Vaccine. Elaboré par une équipe de l'Institut Pasteur et de l'Inserm, ce vaccin s'avère bien toléré et induit une réponse immunitaire dont le niveau laisse présager une protection satisfaisante après une seule administration. L'essai de phase II a été mené par l'Institut Pasteur, en collaboration avec l'Inserm et l'Assistance Publique des Hôpitaux de Paris. Les chercheurs ont désormais l'espoir de pouvoir développer un vaccin efficace et facile à administrer contre les flambées épidémiques de dysenterie bacillaire observées dans les situations de drames humanitaires (catastrophes, guerres civiles, camps de réfugiés), le plus souvent dues à ce sérotype par ailleurs résistant à la plupart des antibiotiques.
Communiqué de presse
Paris, le 15 janvier 2009
Plusieurs années de recherches dans l’unité de Pathogénie microbienne moléculaire, dirigée par Philippe Sansonetti à l’Institut Pasteur (Inserm 786), ont permis la mise au point d’un candidat-vaccin contre Shigella dysenteriae de type 1. Il s’agit d’un vaccin vivant atténué, obtenu par inactivation ciblée de certains gènes de la bactérie impliqués dans sa virulence. « L’immunité peut être atteinte naturellement à la suite d’une shigellose, comme cela a été observé en zone d’endémie », explique Philippe Sansonetti. « Notre candidat-vaccin étant apte à mimer le processus naturel de déclenchement de l’immunité protectrice, nous avions l’espoir qu’il soit efficace ».
Ce vaccin a été nommé « SC599 ». Après un essai de phase I, qui a permis de vérifier sa non-toxicité, l’Institut Pasteur a donc engagé dès 2006, un essai de phase II pour évaluer son immunogénicité. L’essai – qui a inclus 111 volontaires - a été conduit dans deux centres de vaccinologie : le Centre d’Investigation Clinique (CIC) de vaccinologie Cochin-Pasteur à l’hôpital Cochin (Paris), coordonné par le Dr. Odile Launay, et le St George’s Vaccine Institute à Londres, dirigé par le Dr. David Lewis. C’était un essai randomisé, en double-aveugle contre placebo.
Trois groupes de volontaires ont été constitués. L’un a reçu un placebo. Les deux autres groupes ont ingéré une dose du candidat-vaccin, à une concentration différente. Chez environ 40% des sujets, les deux dosages se sont avérés immunogènes, c’est-à-dire capables de déclencher la production de cellules produisant des anticorps spécifiques contre la bactérie.
« La réponse immunitaire induite chez ces volontaires suggère que le vaccin SC599 pourrait conférer une certaine protection chez des personnes exposées à la maladie en zone d’endémie », souligne Marie-Lise Gougeon, l’une des responsables de l’essai, qui dirige l’unité Immunité antivirale, biothérapies et vaccins de l’Institut Pasteur. «Le pouvoir protecteur de ce vaccin ne pourra bien sûr être réellement estimé que par des essais ultérieurs sur le terrain ».
La prochaine étape est le lancement d’un second essai de phase II, déjà en préparation : il visera à utiliser deux doses vaccinales, et non une dose unique. La dose de rappel serait administrée quelques semaines après la dose initiale. « Ce rappel devrait théoriquement permettre d’augmenter le nombre de sujets répondeurs au vaccin », précise Marie-Lise Gougeon.
L’objectif des chercheurs est de réussir à faire du candidat SC599 un vaccin efficace pour le plus grand nombre, peu coûteux et facile à utiliser sur le terrain, puisqu’administré par voie orale.
Cet essai a pu être réalisé grâce à un financement de l’Institut Pasteur et de la Direction générale de l’armement.
Source
« Safety and immunogenicity of SC599, an oral live attenuated Shigella dysenteriae type-1 vaccine in healthy volunteers : results of a phase 2, randomized, double-blind placebo controlled trial » : Vaccine, 2009, sous presse.
Odile Launay 1, Christine Sadorge 2, Nathalie Jolly 2, Béatrice Poirier 3, Stéphane Béchet 2, Diane van der Vliet 1, Valérie Seffer 3, Nicola Fenner 4, Kelly Dowling 4, Raphaela Giemza 4, Julie Johnson 4, Anna Ndiaye 2, Muriel Vray 5, Philippe Sansonetti 6, Philippe Morand7,
Claire Poyart 7, David Lewis 4, Marie-Lise Gougeon 3
1- Université Paris-Descartes ; INSERM ; CIC de Vaccinologie Cochin Pasteur (CIC BT505) ; Pôle de médecine ; Groupe Hospitalier Cochin-Saint Vincent de Paul, Paris, France
2- Centre de Recherche Vaccinale et Biomédicale, Institut Pasteur, Paris, France
3- Unité Immunité Antivirale, Biothérapies et Vaccins, Institut Pasteur, Paris, France
4- St George’s University of London, London SW17 ORE, UK
5- Unité d'Epidémiologie des Maladies Emergentes, Institut Pasteur, Paris, France
6- Unité de Pathogénie Microbienne Moléculaire, Institut Pasteur, Unité INSERM 786, Paris, France
7- Service de Bactériologie, Groupe Hospitalier Cochin-Saint Vincent de Paul ; Assistance Publique-Hôpitaux de Paris ; Centre National de Référence des Streptocoques, Paris, France.
Contacts presse
- Service de presse de l’Institut Pasteur : Corinne Jamma – 01 40 61 33 41 - ou Nadine Peyrolo – 01 45 68 81 46 – presse@pasteur.fr
- Service de presse de l’Inserm : Séverine Ciancia - 01 44 23 60 86 – presse@inserm.fr
- Direction de la communication de l’AP-HP - Service de presse : 01 40 27 37 22 - service.presse@sap.aphp.fr