Microscopes : observer le vivant pour combattre les maladies
A l’œil nu, un être humain peut distinguer un détail d’environ 1 millimètre à une distance de 3 mètres. Titan Krios™, le microscope le plus puissant du monde, qui est inauguré officiellement en juillet 2018 à l'Institut Pasteur, permet aujourd’hui de grossir un objet des millions de fois (contre 10 pour les premiers microscopes) et de voir à l’échelle atomique ! Les chercheurs impliqués dans l’étude des maladies ont désormais accès à toute une gamme de microscopes ultra-perfectionnés qui sont, pour beaucoup d’entre eux, la condition sine qua non de leurs travaux. Avant d’y venir, pour comprendre l’extraordinaire évolution et l’apport de la microscopie, un voyage dans le temps est requis, aux prémices de la conquête de l’infiniment petit.
La découverte d’un nouveau monde
Des opticiens hollandais (Janssen père et fils) auraient élaboré en 1595 le premier microscope en combinant deux lentilles de verre (l’une servant d’objectif grossissant, l’autre d’oculaire), avant même l’apparition de ce terme désignant tout instrument permettant de visualiser des éléments invisibles à l’œil nu - du grec mikros (petit) et skopein (observer). Mais les véritables pères de la microscopie en biologie sont sans conteste l’Anglais Robert Hooke et le Hollandais Antoni Van Leeuwenhoek. Grâce à un microscope à trois lentilles élaboré par ses soins, Hooke fit de nombreuses observations (ailes d’insectes, puces, poux…) qu’il dessina, commenta et compila dans son traité Micrographia, publié en 1667, première incursion documentée dans le monde microscopique. On lui doit le terme de cellule, unité de base des organismes vivants (notre corps en contient 10 000 milliards …), attribué aux petites alvéoles qu’il distingua dans des lamelles de liège.
Des « animalcules » sous le microscope
Peu après, Van Leeuwenhoek fabriqua des microscopes beaucoup plus puissants, grossissant 200 fois contre 20 pour celui de Hooke, sous lesquels il observa quantité d’éléments : gouttes de pluie, plaque dentaire, morceaux d’intestin, de moules… Il est célèbre pour avoir été le premier à voir des bactéries, qu’il nomma « animalcules », rapportant sa découverte à la Royal Society de Londres en 1673. Deux siècles plus tard, Louis Pasteur prouva que des « animalcules » étaient la cause de maladies, et les premières bactéries pathogènes furent découvertes sous le microscope : le bacille de la tuberculose par l’Allemand Robert Koch (1882) ou celui de la peste par le pasteurien Alexandre Yersin (1894). Mais des agents infectieux comme les virus – mille fois plus petits que les bactéries – restaient invisibles. Ainsi Louis Pasteur mit au point le vaccin contre la rage en sachant qu’un agent transmissible était en cause mais sans l’avoir jamais vu (le virus ne fut visualisé qu’en 1962…).

Microscopie optique, microscopie électronique
Pour observer des virus, il faudra descendre à l’échelle du nanomètre (soit un milliardième de mètre, 50 000 fois plus petit que le diamètre d’un cheveu) - le virus de la grippe par exemple mesure environ 100 nanomètres -, et attendre l’avènement dans la deuxième moitié du XXe siècle des microscopes électroniques, dont les premiers prototypes furent créés par des ingénieurs allemands au début des années 30. Au lieu d’utiliser la lumière (composée de photons) et des lentilles de verre, ils eurent l’idée d’utiliser des électrons, beaucoup plus petits que les photons, accélérés sous vide dans des tubes cathodiques, et des lentilles électromagnétiques. Le résultat fut la visualisation d’éléments encore plus minuscules que ceux visibles avec des microscopes optiques.
Sida, Zika : la traque des virus par l’image
« Le monde microscopique est magnifique ! » témoigne Olivier Schwartz, responsable de l’unité Virologie et immunité à l’Institut Pasteur. « Ses images permettent d’illustrer, voire de générer nos découvertes. Pour étudier les interactions entre les virus et les cellules de l’organisme, j’ai toujours utilisé différentes techniques de microscopie et assisté aux progrès gigantesques de ces dernières années, que ce soit en microscopie optique, optimale pour observer des cellules - ou en microscopie électronique, qui permet notamment de visualiser les virus. Aujourd’hui, nous combinons les deux, à la manière de Google Maps : nous pouvons avoir une vue d’ensemble – voir des cellules infectées et non infectées par exemple - puis nous rapprocher des détails, de plus en plus fins, jusqu’à voir des particules virales sur la membrane d’une cellule. » A l’origine d’importantes découvertes sur les « relations » entre le virus du sida et ses cellules cibles (les lymphocytes T CD4, voir image), l’équipe d’Olivier Schwartz s’intéresse aussi de près aux virus émergents comme Chikungunya ou Zika. « La vidéo microscopie nous permet de filmer en temps réel l’action de virus rendus fluorescents sur des cellules, et nous avons ainsi pu récemment observer et décrire l’implosion de cellules infectées par le virus Zika*, qui pourrait être une défense propre à l’organisme pour se débarrasser du virus, nous cherchons à le savoir. » Sur le bureau du chercheur, non loin d’une petite collection de microscopes « vintage », trône une drôle de structure blanche : trois sphères de la taille d’une mandarine reliées entre elles par des « bras ». Grâce une image de microscopie confocale et à une imprimante 3D, il peut aujourd’hui tenir entre ses mains, faire tourner et voir à l’œil nu ces cellules « en communication », bien réelles à l’origine. On n’arrête pas le progrès !
Voir La lettre de l’Institut Pasteur n°98
A chaque expérience son microscope
Mais avec les microscopes électroniques, on ne peut observer que des éléments figés dans des coupes utltrafines (d’une cinquantaine de nanomètres) et « fixés » par des éléments chimiques ou par le froid (cryogénie). Seuls les microscopes optiques permettent d’examiner des éléments vivants (dans des cellules en culture ou des modèles expérimentaux) – et donc de visualiser en temps réel de phénomènes pathologiques : l’invasion d’un tissu par une bactérie, le mouvement de cellules métastatiques… et même de les filmer (vidéomicroscopie). Les instruments se sont spécialisés : microscopes électroniques à transmission, à balayage (pour distinguer les reliefs - voir vidéo ci-dessous), microscopes optiques confocal (pour voir en 3 dimensions), biphotonique (pour observer en profondeur …). A chaque expérimentation son microscope, et les biologistes utilisent souvent plusieurs types de microscopes pour avoir des vues d’ensemble puis des détails (voir encadrés ci-dessus et ci-dessous), des méthodes de microscopie « corrélative » permettant de relier les différents niveaux d’observation. Mais les progrès de la microscopie ne dépendent pas uniquement de l’amélioration des instruments eux-mêmes.
C'est quoi un microscope électronique à balayage ?
Une vidéo du youtubeur e-penser (Bruce Benamran).
Méningites : pister les bactéries au cœur de nos vaisseaux
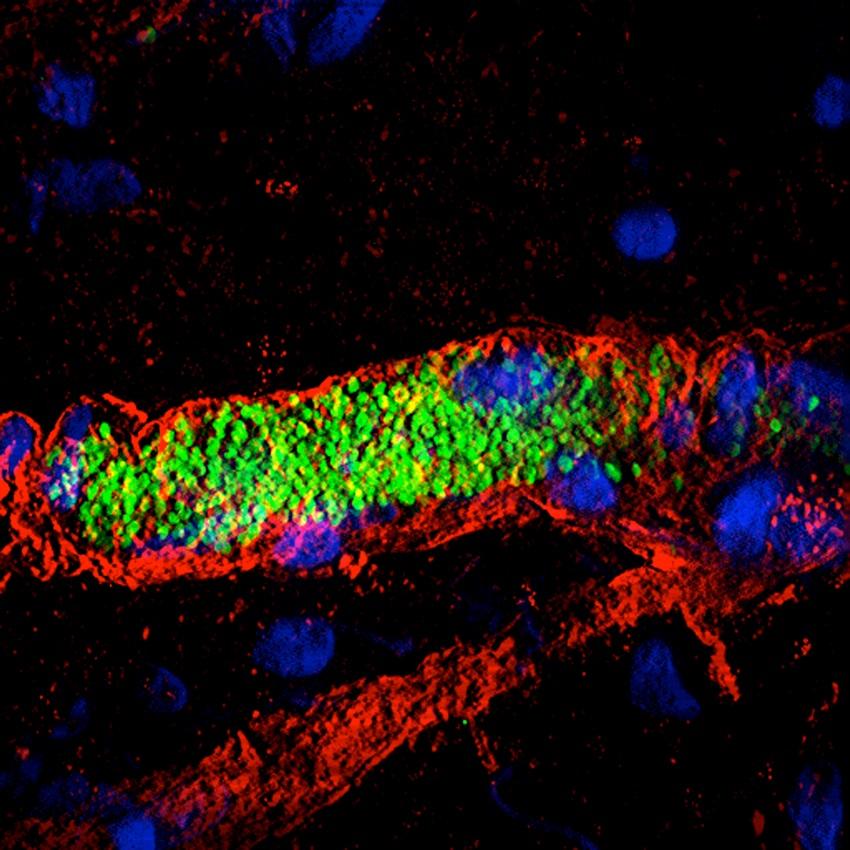
« Nous étudions une étape clé de l’infection par les méningocoques, responsables de graves méningites et de septicémies : la capacité de ces bactéries à interagir avec des vaisseaux sanguins et à s’y coller » explique Guillaume Dumenil, responsable de l’unité Pathogénèse des infections vasculaires à l’Institut Pasteur. « Ces bactéries s’agglutinent et se multiplient dans de petits vaisseaux jusqu’à les boucher. Ces vaisseaux finissent par se déchirer compromettant la circulation sanguine lors des septicémies et, libérant les bactéries dans le liquide céphalo-rachidien lors des méningites. Nous observons cette "colonisation vasculaire" en temps réel sur des modèles expérimentaux, grâce à un dispositif de microscopie installé sur une table antivibratoire et sous une hotte, pour éviter les contaminations*. En complément, sur un microscope électronique de l’unité de Bioimagerie ultrastructurale, nous étudions des coupes de tissu avec un niveau de détail énorme. Un autre microscope, à fluorescence, nous a permis de voir comment les bactéries s’enveloppent dans la membrane des cellules de la paroi du vaisseau pour s’y accrocher. C’est la combinaison de toutes ces techniques qui nous donne une idée précise de ce qui se passe dans l’organisme. » A la clé : l’identification des facteurs d’adhésion au vaisseau utilisés par les méningocoques, cibles thérapeutiques potentielles.
*Coût du dispositif : 500 000 euros.

Guillaume Dumenil, responsable de l’unité Pathogénèse des infections vasculaires à l’Institut Pasteur.
Nous étudions une étape clé de l’infection par les méningocoques, responsables de graves méningites et de septicémies : la capacité de ces bactéries à interagir avec des vaisseaux sanguins et à s’y coller.
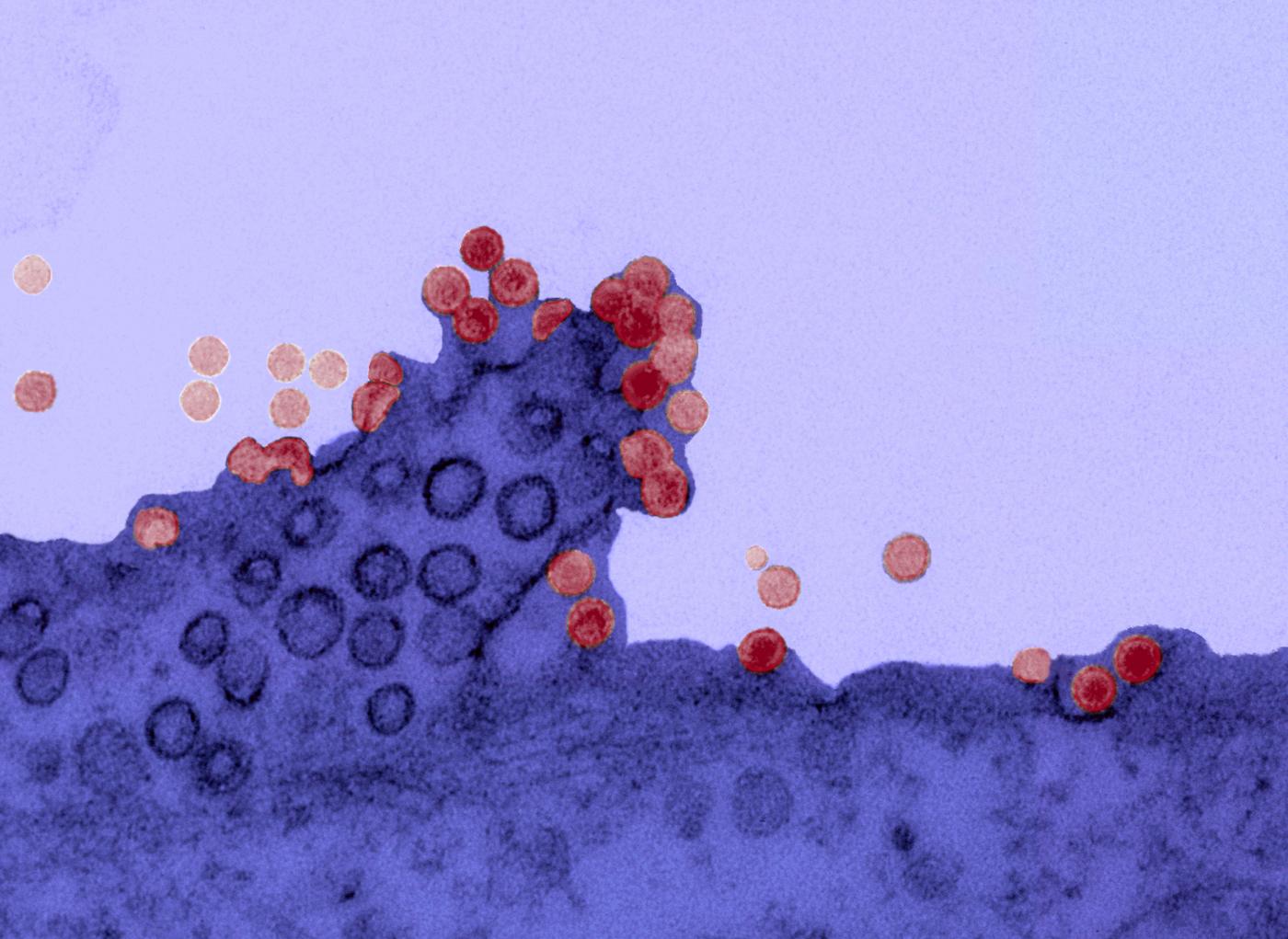
Virus chikungunya a la surface d'une cellule. Crédit : Institut Pasteur.
La « révolution verte » de la microscopie
Ainsi, une avancée majeure est née de la découverte en 1962 d’une protéine fluorescente verte… chez une méduse ! On la surnomme GFP (de l'anglais Green Fluorescent Protein). Couplée génétiquement à une protéine qu’on souhaite étudier, la GFP la « marque », telle une étiquette fluo. Grâce à ce « mouchard » moléculaire et au microscope à fluorescence, l’activité d’une biomolécule dans son environnement naturel peut être « signalée » en vert, sans que sa fonction soit altérée (des « fluorochromes » auparavant utilisés pour marquer des molécules étaient toxiques pour la cellule). On put « tagger » des cellules, des bactéries ou des virus, suivre leur itinéraire dans l’organisme, voir où et quand une protéine donnée est fabriquée et en quelle quantité (selon l’intensité de la fluorescence). La GFP déclencha une véritable révolution « verte » en microscopie dans les années 90 et valut aux trois scientifiques qui l’avaient initiée un prix Nobel de Chimie en 2008. L’un d’eux réussit à modifier la GFP pour obtenir des protéines fluos de toutes les couleurs (rouge, bleu..), et marquer ainsi simultanément différents éléments. La révolution vira arc-en-ciel… la GFP est aujourd’hui utilisée en routine dans de très nombreux laboratoires partout dans le monde.
Tumeurs cérébrales : le poisson zèbre sous le microscope
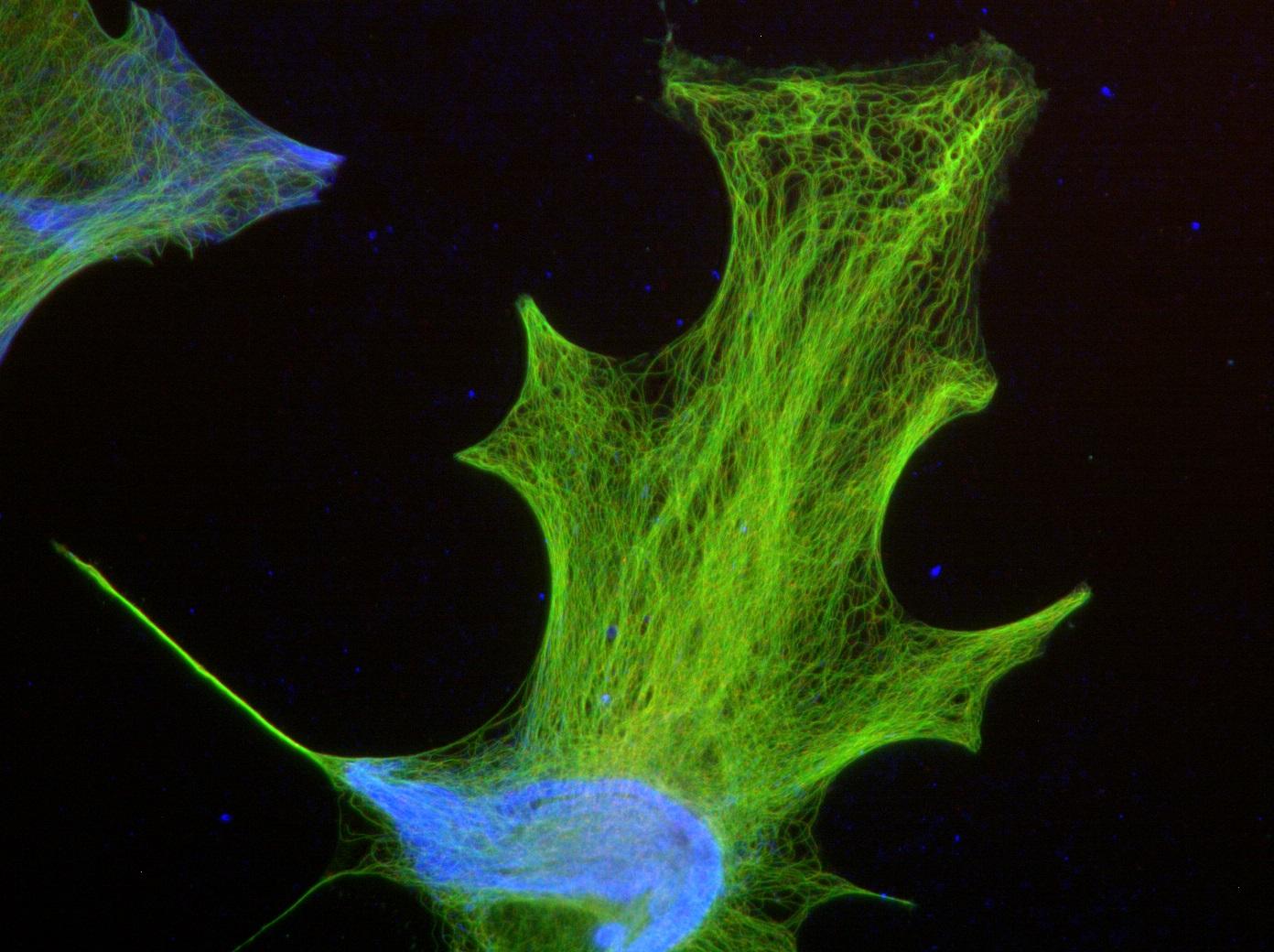
Il est un petit poisson tropical – dont la taille à l’âge adulte ne dépasse pas 5 cm - devenu un modèle d’étude pour de nombreux biologistes : le poisson zèbre. Beaucoup le choisissent pour la transparence de ses larves, qui permet d’observer en direct - au vidéo microscope* - les phénomènes biologiques qui s’y déroulent. Il est par exemple au centre d’un des projets de l’équipe de Sandrine Etienne-Manneville (unité Polarité cellulaire, migration et cancer), spécialisée dans l’étude de graves tumeurs cérébrales, les gliomes, deuxième type de cancer le plus fréquent chez l’enfant. « En injectant des cellules de gliomes humains dans le cerveau des poissons, nous pouvons étudier leur comportement, en particulier leur migration, pour mieux comprendre les interactions entre les cellules tumorales et les cellules environnantes au cours de l’invasion du tissu cérébral », explique la chercheuse. « Nous espérons ainsi améliorer le diagnostic des gliomes des patients en déterminant leurs propriétés invasives, mais aussi utiliser ce modèle pour tester de manière simple, rapide et physiologique, l’effet de traitements potentiels de ces tumeurs, en ajoutant des composés pharmacologiques directement dans l’eau des poissons.»
*Coût du vidéo microscope : 350 000 euros.

Sandrine Etienne-Manneville, chercheuse au sein de l'unité Polarité cellulaire, migration et cancer, à l'Institut Pasteur.
Nous espérons améliorer le diagnostic des gliomes des patients en déterminant leurs propriétés invasives.
L’ère de la nanoscopie
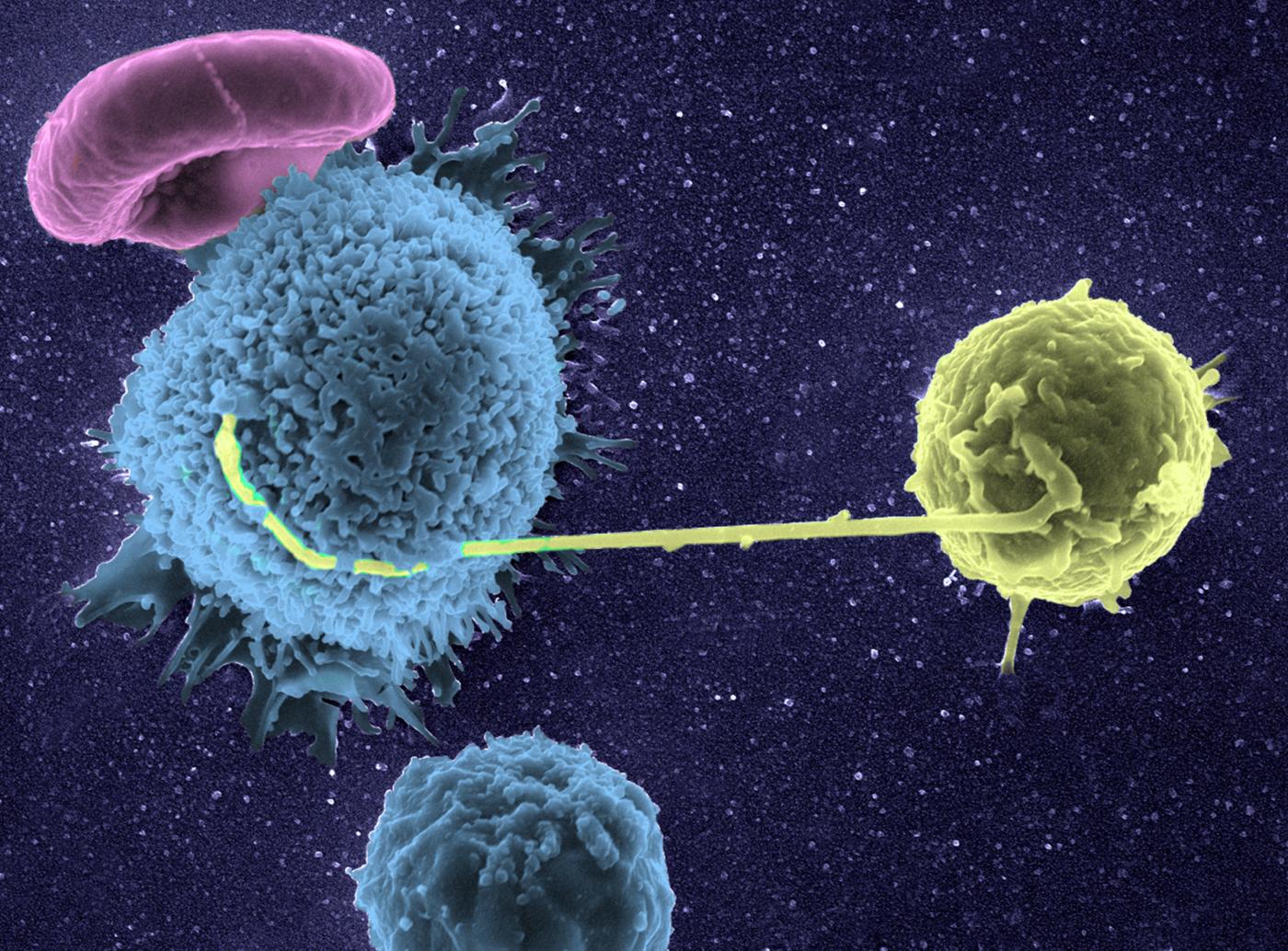
Aujourd’hui, pas moins de sept prix Nobel de chimie ont été attribués à des scientifiques ayant amélioré la microscopie dont celui de 2017, à trois chercheurs ayant développé la cryo-microscopie (voir encadré Titan plus bas). Mieux équipés pour « voir », les chercheurs bénéficient aussi d’outils pour interpréter leurs observations, comme l’analyse automatisée des images permises par de puissants algorithmes (voir exemple "Analyse d’images : mieux que le cerveau humain"). Grâce à au développement phénoménal des performances de la microscopie et des outils associés, les chercheurs engagent aujourd’hui des études qu’ils n’auraient pas imaginé pouvoir réaliser il y a seulement quelques années, qu’il s’agisse de suivre la migration de nouveaux neurones dans le cerveau ou de visualiser la destruction de cellules cancéreuses par nos cellules immunitaires (voir exemple ci-dessous). L’exploration du monde microscopique (et nanoscopique !) révèle des informations cruciales pour la lutte contre les maladies, accélérant par exemple l’identification de molécules-clés, nouvelles cibles pour les médicaments de demain. Sources de tous ces possibles, les microscopes pourraient être élevés au rang de "héros technologiques" de la recherche biomédicale...
Analyse d’images : mieux que le cerveau humain

Pour faire avancer les connaissances, il ne suffit pas d’avoir les meilleurs microscopes, il faut pouvoir analyser les images qu’ils génèrent. « Très souvent, il s’agit de compter, par exemple : combien de centaines de cellules de telle ou telle forme sont dans l’image ? » explique Jean-Christophe Olivo-Marin, responsable de l’unité d'Analyse d'images biologiques. « Ces tâches sont rébarbatives et pas toujours reproductibles : selon que l’expérimentateur les effectue le matin, l’après-midi ou le soir, le résultat n’est pas le même… L’ordinateur, lui, donne toujours le même nombre. » Née des mathématiques appliquées dans les années 80, l’analyse d’images est aujourd’hui au cœur des technologies de pointe. « Mon équipe de mathématiciens et de physiciens développe des algorithmes pour l’imagerie biologique, pour modéliser par exemple comment des cellules comme les amibes ou les cellules métastatiques de cancer du sein se déforment pour se déplacer. Calculer la trajectoire d’une cellule dans un film de vidéo microscopie 3D d’une heure prendrait des jours à un chercheur quand l’analyse d’images le fait désormais en temps réel. Nos outils surpassent souvent les capacités de l’humain. »
Rejet de greffes, cancers : nos cellules de défense visualisées en 3D en temps réel !
Pionnier de l’imagerie appliquée à l’étude du système immunitaire, Philippe Bousso étudie le comportement de nos cellules de défense dans des phénomènes pathologiques comme le rejet de greffe ou les cancers. L’unité des Dynamiques des réponses immunes qu’il dirige à l’Institut Pasteur produit des films bien particuliers : on y voit par exemple des cellules de nos défenses naturelles donner le « baiser de la mort » à des cellules cancéreuses. « Nous utilisons pour cela un microscope très performant* et des techniques adaptées développées au laboratoire pour des observations in vivo et en temps réel. L’une d’elles nous permet par exemple de détecter la mort d’une cellule par un changement de couleur. La possibilité de visualiser les cellules dans les conditions réelles a révolutionné la conception qu’on avait du fonctionnement du système immunitaire, beaucoup plus compliqué qu’on ne l’imaginait : ses cellules se déplacent sans cesse, coopèrent et composent de véritables chorégraphies lors d’une réaction de défense. »
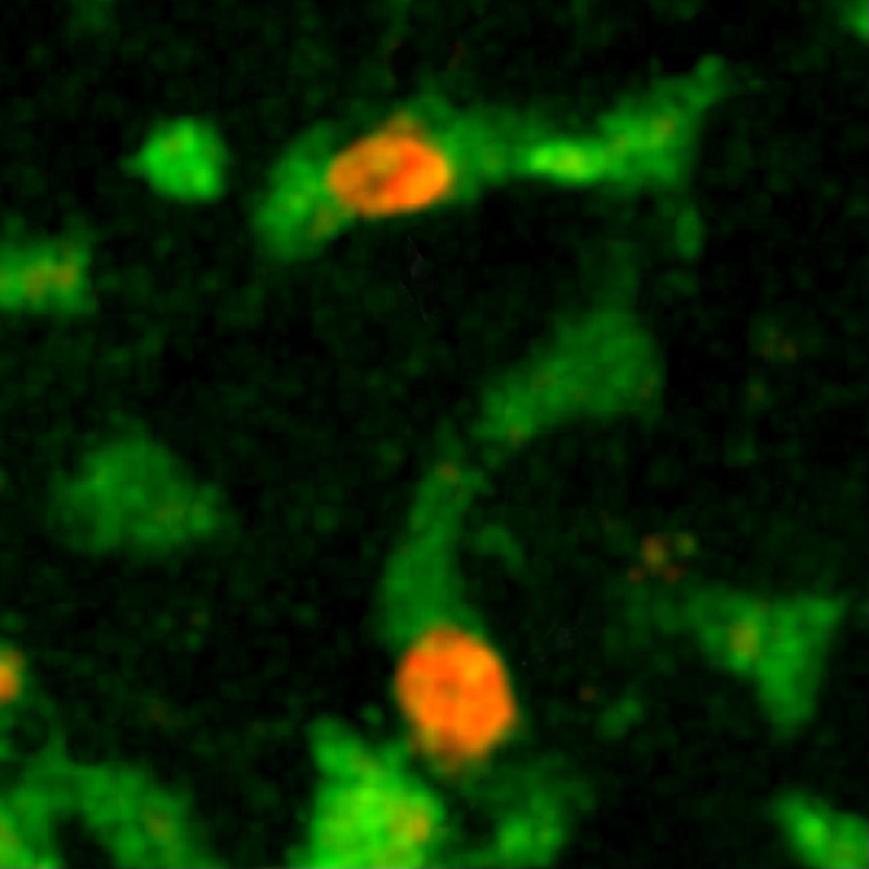
En observant le « ballet » des cellules immunitaires lors d’un rejet de greffe de peau, l’équipe a pu en 2011 prouver l’existence d’un mécanisme cellulaire en jeu, ouvrant la voie à la conception de nouveaux traitements « anti-rejet ». Plus récemment, elle a réalisé d’importantes avancées sur des immunothérapies contre les cancers, ces traitements qui stimulent le système immunitaire du malade pour qu’il attaque ses cellules tumorales, décryptant notamment l’action de greffes de moelle ou de molécules utilisées pour soigner des lymphomes (cancers du sang). « Les immunothérapies sont en plein essor mais souvent, on sait qu’elles fonctionnent sans savoir pourquoi. Comprendre comment les cellules immunitaires réagissent lors de ces thérapies ouvre la voie à l’amélioration des traitements existants ou à la découverte de nouvelles pistes thérapeutiques. L’imagerie dynamique est de plus un outil puissant pour tester des médicaments : leur effet est immédiatement visible, en temps réel. »
*Un microscope biphotonique. Coût : 400 000 euros.
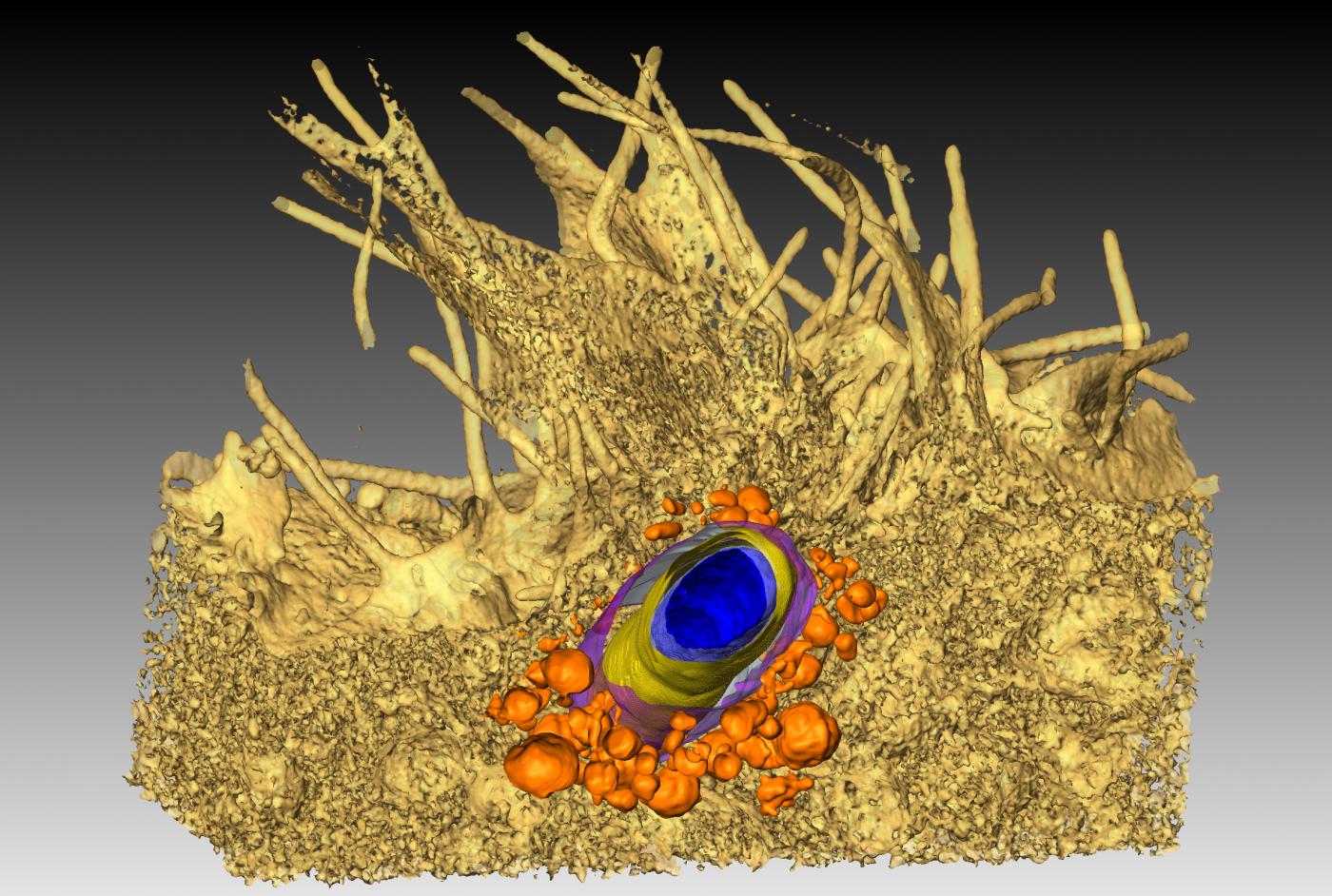
Le microscope le plus puissant du monde…
En partie financé par de généreux donateurs, le microscope le plus puissant du monde, Titan Krios™, est en cours d’installation sur le campus de l’Institut Pasteur.
Ce « cryo-microscope* » à très haute résolution ressemble à une grande armoire de 3,8 mètres de haut, reliée à des écrans d’ordinateur restituant les images. Son premier atout - mais pas le seul - est la résolution qui peut être atteinte, qui se mesure en quelque dixièmes de nanomètre, soit l’échelle atomique. Tout un pan de la machinerie cachée de la cellule peut être visualisé, de même que la structure de protéines impliquées dans des maladies, utile par exemple pour concevoir des médicaments. Titan Krios™ ouvre la voie à des études jusqu’alors inimaginables pour des chercheurs issus de nombreuses disciplines travaillant sur des maladies aussi éloignées qu’Alzheimer ou le paludisme. Un autre atout vient de sa capacité à générer rapidement quantité de données : robotisé, il permet d’observer jusqu’à 12 échantillons en même temps et de lancer une collecte d’images sur plusieurs jours. Un gain de temps considérable pour la recherche.
Titan KriosTM : l'Institut Pasteur au plus près du vivant. Crédit : Institut Pasteur
Un tel bijou technologique ne s’installe pas n’importe où. « Il est tellement sensible qu’un simple cri pourrait ruiner une expérimentation », ironisait un de ses utilisateurs au Royaume-Uni. Un bâtiment a été spécialement construit pour l’accueillir, doté d’un blindage électromagnétique et conçu pour amortir la moindre vibration. « Un grand nombre de processus liés aux pathologies étudiées à l’Institut Pasteur sont candidats à l’utilisation du Titan Krios™ et une longue liste de projets - qui doivent passer par un comité de sélection - est déjà en attente », précise Michael Nilges, directeur du département de Biologie Structurale et Chimie. « Nous venons aussi de créer une nouvelle unité de recherche spécialisée en microscopie électronique à haute résolution, pour faciliter son utilisation.»
*Les échantillons sont congelés à moins 180°C pour fixer les molécules dans leur environnement.
Titan KriosTM : retour en images sur un chantier pharaonique. Crédit : Institut Pasteur.
…et des experts en imagerie
Bien d’autres microscopes existent sur le campus pasteurien, installés dans les laboratoires de recherche ou, pour les plus perfectionnés, dans deux unités du Centre d’innovation et recherche technologique, l’une dédiée à la microscopie optique, l’autre à la microscopie électronique. « Nous aidons les chercheurs à choisir la méthode la plus adaptée à leurs besoins et à utiliser l’un ou l’autre de nos cinq microscopes électroniques haute résolution », explique Jacomine Krijnse-Locker, responsable de l’unité de Bioimagerie ultrastructurale. « Ils ont par exemple servi à visualiser les agrégats formés par le virus Chikungunya dans les glandes salivaires du moustique, l’entrée de la bactérie Shigella dans des cellules humaines ou la modification de la paroi de bactéries responsables de méningites sous l’effet d’un antibiotique. En 2016, nous avons ainsi contribué à 85 projets de recherche. » Non loin de là est installée l’unité de Bioimagerie photonique et ses 30 microscopes optiques de haut niveau, utiles à l’observation d’éléments vivants. Pour son responsable, Spencer Shorte « les deux unités de microscopie sont complémentaires et collaborent sur de nombreux projets. A côté de notre activité de service, nous faisons de la recherche technologique pour améliorer les méthodes d’imagerie optique, notamment appliquées à la biologie cellulaire et à la microbiologie. Nous voulons repousser encore les limites actuelles ! »
*Coût : entre 700 000 et plus de 1 million d’euros.





