Une équipe de chercheurs a mis en lumière un gène (CSA6) régulateur de la stabilité génomique chez Candida albicans et d’autres champignons apparentés. Le produit de ce gène, la protéine Csa6, constitue une cible potentielle pour la thérapie antifongique, alors que le développement de nouveaux traitements pour la prise en charge des infections fongiques est une nécessité absolue.
Candida albicans est un champignon présent chez la plupart des individus en bonne santé : il s’implante généralement sur les muqueuses du tube digestif et des voies génitales. Mais, chez certaines personnes immunodéprimées, telles que les malades du sida ou du cancer, il devient un pathogène. Il déjoue les défenses de l’hôte et va jusqu’à provoquer des infections systémiques qui peuvent être mortelles (lire la fiche maladie Candidoses). La prise en charge de ces infections est rendue difficile par le peu de classes d’antifongiques dont on dispose. A cela s’ajoute l’émergence de cas de résistance de C. albicans (et d’espèces apparentées) à ces médicaments. La résistance aux antifongiques de C. albicans est accentuée par l’importante plasticité de son génome, c’est-à-dire sa capacité à modifier le nombre de copies de ses chromosomes et leur organisation.
Le gène CSA6, un régulateur critique du cycle cellulaire
Dans le cadre d’une étude collaborative récente, des chercheurs de l’Institut Pasteur (à Paris) et du Jawaharlal Nehru Centre for Advanced Scientific Research (JNCASR) en Inde ont examiné l’effet de la surexpression de plus d’un millier de gènes de C. albicans, pris individuellement, sur la stabilité de son génome. Ils sont ainsi parvenus à repérer un régulateur critique du cycle cellulaire.
« Parmi six gènes identifiés comme impliqués dans la plasticité du génome, CSA6 a attiré notre attention. Sa fonction était encore inconnue, mais la modulation de son niveau d’expression impactait la survie de la cellule, en altérant le bon fonctionnement du cycle cellulaire. S’il est inactivé, la croissance de C. albicans s’arrête, mais s’il est surexprimé, la morphologie des cellules change, elles adoptent une croissance polarisée » explique Christophe d’Enfert, co-dernier auteur de l’article, responsable de l’unité Biologie et pathogénicité fongiques à l’Institut Pasteur. Cette unité est associée au département Mycologie de l’Institut Pasteur et au département Microbiologie et chaîne alimentaire de l’Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (Inrae, USC 2019).
Un schéma pour l’identification d’autres gènes pertinents, cibles potentielles pour la thérapie antifongique
Pour mieux comprendre la fonction du gène CSA6, les scientifiques ont eu recours à des techniques d’imagerie cellulaire. « En couplant la protéine Csa6 à une protéine fluorescente, nos collègues du JNCASR ont pu observer sa localisation dans le noyau, au niveau du centrosome, la structure qui permet la séparation des chromosomes dans les deux cellules au moment de la mitose », poursuit Christophe d’Enfert.
Les chercheurs ont également constaté que cette protéine était sélectivement présente chez des espèces de levures proches de C. albicans, comme Candida dubliniensis, Candida tropicalis et Candida parapsilosis.
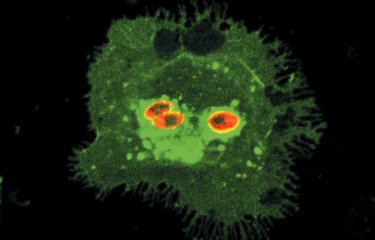
 Structures aberrantes et contrastées du fuseau mitotique après surexpression (à gauche) et déplétion (à droite) de Csa6 dans des cellules de Candida albicans avec bourgeon allongé. |
L’étude en cours est la toute première sur un criblage par surexpression de gènes d’une telle ampleur chez ce pathogène fongique humain. Elle détermine et décrypte les fonctions d’un nouveau régulateur de la stabilité génomique, exclusivement présent dans un groupe de levures comprenant de nombreux pathogènes fongiques humains médicalement pertinents, et fournit un schéma systématique d’identification d’autres gènes.
Les protéines ainsi identifiées sont de nouvelles cibles potentielles pour la thérapie antifongique, alors que le développement de cibles médicamenteuses visant les levures pathogènes est une nécessité absolue. En effet, des résistances aux thérapies existantes apparaissent chez les champignons du genre Candida, à l’origine d’infections souvent mortelles, chez les patients fragiles (en soins intensifs, atteints d’un cancer ou sous traitement immunosuppresseur).
Cette étude a bénéficié du financement du Centre franco-indien pour la promotion de la recherche avancée (CEFIPRA). Ce soutien financier a permis aux groupes français et indien d’unir leur expertise en génomique fonctionnelle et dans l’étude de la dynamique du génome des pathogènes fongiques humains.
Auteure principale de l’article, la Dr Priya Jaitly est une ancienne doctorante du Jawaharlal Nehru Centre for Advanced Scientific Research (JNCASR), dans l’équipe du Pr. Kaustuv Sanyal, responsable du Molecular Mycology Laboratory et co-dernier auteur de cette étude. Le Dr Priya Jaitly s’est rendue à l’Institut Pasteur (à Paris) pour participer à la recherche collaborative.
Source
A phylogenetically-restricted essential cell cycle progression factor in the human pathogen Candida albicans, Nature Communications, 23 juillet 2022
Priya Jaitly1 , Mélanie Legrand2, Abhijit Das1,5, Tejas Patel1,5, Murielle Chauvel2, Corinne Maufrais3, Christophe d’Enfert2 & Kaustuv Sanyal1,4
1 Molecular Mycology Laboratory, Molecular Biology and Genetics Unit, Jawaharlal Nehru Centre for Advanced Scientific Research, Bangalore, India.
2 Institut Pasteur, Université Paris Cité, INRAE, USC2019, Unité Biologie et Pathogénicité Fongiques, F-75015 Paris, France.
3 Institut Pasteur, Université Paris Cité, Bioinformatics and Biostatistics Hub, F-75015 Paris, France.
4 Osaka University, Suita, Osaka, Japan.
5 These authors contributed equally