Fidèle à la mission pasteurienne qui vise à répondre aux enjeux de santé humaine, l’Institut Pasteur s’engage dans la thématique du vieillissement. Cherchant à comprendre le déclin de la fonction des tissus dans les organismes, des chercheurs de l’unité Cellules Souches et Développement de l’Institut Pasteur viennent de faire une découverte sur les mécanismes encore méconnus du modèle d’horloge épigénétique dans les cellules souches.
Les modifications épigénétiques ont été proposées comme une cause majeure de la dégradation des tissus liée à l’âge. Parmi elles, c’est en particulier une modification appelée « méthylation de l’ADN » qui est en cause. Les modèles prédictifs d’âge, basés sur l’épigénétique et également appelés horloges épigénétiques, ont été largement appliquées au cours des dernières années et les scientifiques convenaient jusqu’alors qu’ils étaient censés refléter le vieillissement chronologique. Malgré leur précision, les mécanismes à la base de ces modèles restent largement inconnus. C’est pourquoi l’équipe de Shahragim Tajbakhsh à l’Institut Pasteur, en collaboration avec l’équipe de Wolf Reik à l’Institut Babraham a tenté de décrypter ces phénomènes.
« En observant des cellules souches musculaires, nous avons découvert que l’ADN se transcrit* de manière plus chaotique dans les cellules souches âgées que dans les jeunes. Notre étude indique que la méthylation de l’ADN est associée aux modifications de transcription liées au vieillissement. C’est la première fois qu’une telle découverte est faite dans une population de cellules souches », souligne Shahragim Tajbakhsh, responsable de l’unité Développement et cellules souches à l’Institut Pasteur.
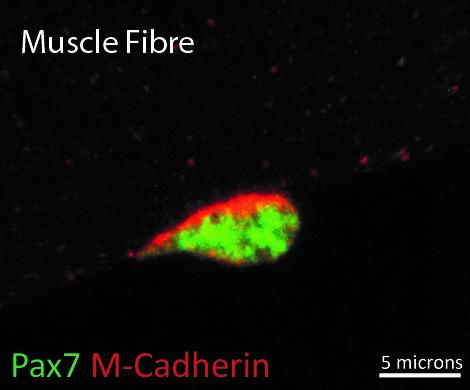
Chez les cellules souches âgées, des modifications à la fois transcriptionnelles et épigénétiques associées au vieillissement ont donc été observées. Alors que les cellules souches âgées montrent une légère augmentation de la méthylation de leur ADN, cette méthylation ne correspond pourtant pas à leur âge chronologique. Il faut savoir que les horloges épigénétiques basées sur la méthylation de l’ADN sont construites à partir de données provenant de multiples tissus, correspondant à un mélange de différents types de cellules. « Nous avançons l’hypothèse que de petits changements dans la composition cellulaire au cours du vieillissement puissent affecter l’âge épigénétique d’un tissu », résume Shahragim Tajbakhsh. Les cellules souches, dont le nombre diminue généralement au cours du vieillissement, pourraient être l’une de ces populations cellulaires affectant l’âge épigénétique du tissu.
Cette découverte sur le vieillissement souligne l'importance de la recherche fondamentale pour comprendre les mécanismes qui régulent les propriétés et les fonctions des cellules souches afin d'ouvrir la voie au développement futur de stratégies diagnostiques ou thérapeutiques innovantes.
* La transcription est le processus par lequel les gènes portés par l’ADN sont codés sous une autre forme (ARN), cet ARN étant ensuite traduit en protéines.
Source
Ageing affects DNA methylation drift and transcriptional cell-to-cell variability in mouse muscle stem cells, Nature Communications, 25 septembre 2019
Irene Hernando-Herraez1,7, Brendan Evano2,3,7, Thomas Stubbs1,6,7, Pierre-Henri Commere4, Marc Jan Bonder5, Stephen Clark1, Simon Andrews1, Shahragim Tajbakhsh2,3 & Wolf Reik1
1 Epigenetics Programme, Babraham Institute, Cambridge, UK
2 Stem Cells & Development, Department of Developmental & Stem Cell Biology, Institut Pasteur, Paris, France
3 CNRS UMR 3738, Institut Pasteur, Paris, France
4 Cytometry and Biomarkers, Center for Technological Resources and Research, Institut Pasteur, Paris, France
5 European Molecular Biology Laboratory, European Bioinformatics Institute, Wellcome Genome Campus, Hinxton, UK
6 Chronomics Limited. Mills & Reeve Llp, 1 St James Court, Norwich, UK