Des scientifiques du CNRS, de l’Institut Pasteur, de l’Institut flamand de biotechnologie et de l’Université libre de Bruxelles viennent de livrer la première étude de la structure et du fonctionnement d’une protéine centrale du foie : NTCP, porte d’entrée des sels biliaires, mais aussi de certains virus de l’hépatite. Publiés dans la revue Nature, ces résultats dévoilent la structure 3D de NTCP, et deux formes qu’elle peut adopter. L’une d’entre elles pourrait aider à la mise au point d’outils thérapeutiques contre l’infection par les virus de l'hépatite.
C’est une porte d’entrée essentielle du foie, pourtant encore peu décrite jusqu’à aujourd’hui. NTCP (pour Na+-taurocholate co-transporting polypeptide) est une protéine située dans la membrane des cellules hépatiques, et exclusive dans ces cellules, qui leur permet de recycler les acides biliaires. Elle est également la cible des virus humains de l'hépatite B et D (VHB/VHD). Mieux la comprendre pourrait donc mener d’une part au développement de traitements ciblant spécifiquement le foie, et d’autre part à lutter contre l’infection par le VHB et le VHD.
NTCP est une protéine difficile à étudier. Elle ne pèse que 38 kilodalton (kDa)1 alors que la technologie utilisée pour étudier ce type de molécules, la cryo-microscopie électronique, ne fonctionne que pour des molécules dont le poids est supérieur à 50 kDA. Tout l’enjeu était donc de la « grossir » et de la stabiliser.
Pour cela, les équipes de laboratoires français et belge2 ont mis au point et testé toute une collection de fragments d’anticorps ciblant NTCP. La structure 3D des complexes ainsi formés a pu être déterminée par cryo-microscopie électronique pour ensuite remonter à celle de la protéine. Les différents fragments d'anticorps ont de plus permis de stabiliser plusieurs formes de NTCP et ainsi de les observer.
L’équipe de recherche a pu décrire deux conformations que peut adopter NTCP : une première où la protéine ouvre une large porte d’entrée pour les sels biliaires, à laquelle le VHB et le VHD peuvent se fixer, et une deuxième, « fermée », repliée de telle manière qu’elle empêche le ciblage par les virus.
La première conformation, « ouverte », est très surprenante, car aucun autre transporteur moléculaire connu ne forme de pore de ce genre, « grand ouvert ». Quant à la deuxième, elle pourrait aider à guider la recherche de molécules empêchant l’infection par le VHB et le VHD. L’équipe de recherche compte désormais poursuivre ses travaux pour élucider pleinement le fonctionnement de NTCP.
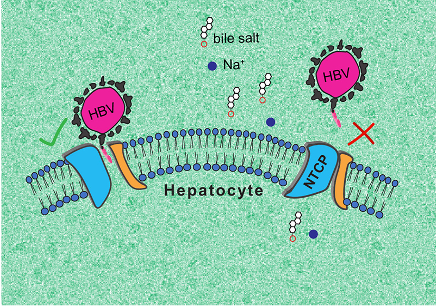
Illustration des deux conformations 3D que peut adopter NTCP.
À gauche, la forme “ouverte” à laquelle le VHB et le VHD peuvent se fixer et à droite la forme « fermée » qui empêche le ciblage par les virus.
© Kapil Goutam/Nicolas Reyes/CNRS
Source
Structural basis of sodium-dependent bile salt uptake into the liver.
Kapil Goutam1,2, Francesco S. Ielasi2, Els Pardon3,4, Jan Steyaert3,4 et Nicolas Reyes1,2. Nature, le 11 mai 2022.
1Membrane Protein Mechanisms Group, European Institute of Chemistry and Biology, University of Bordeaux, CNRS-UMR5234, 33607 Pessac, France.
2Membrane Protein Mechanisms Unit, Institut Pasteur, 75015 Paris, France
3Structural Biology Brussels, Vrije Universiteit Brussel, VUB, Brussels, Belgium 4VIB-VUB Center for Structural Biology, VIB, Brussels, Belgium
1- Un dalton représente un douzième de la masse d'un atome de carbone 12, autrement dit environ la masse d'un atome d'hydrogène.
2- Ont participé des équipes du laboratoire Microbiologie fondamentale et pathogénicité (CNRS/Université de Bordeaux), de l’unité Mécanismes des protéines membranaires à l’Institut Pasteur et de l’Institut flamand de biotechnologie de l’Université libre de Bruxelles. Cette étude a bénéficié entre autres du soutien financier de l’ANRS | Maladies infectieuses émergentes.



