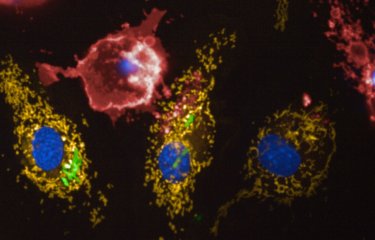
Des chercheurs de l’Institut Pasteur, du CNRS et de l’Inserm, en collaboration avec une équipe suisse*, ont démontré que la bactérie Legionella pneumophila, agent de la légionellose, survit au sein des cellules hôtes en ciblant spécifiquement leurs mitochondries. En fragmentant les mitochondries, L. pneumophila engendre une perturbation dans la chaîne respiratoire de la cellule, ce qui lui permet de se multiplier plus facilement en son sein. Ces résultats suggèrent qu’une stratégie thérapeutique visant à empêcher les dommages causés aux mitochondries pourrait contribuer à combattre les infections bactériennes dues à L. pneumophila. Cette étude a été publiée le 31 août sur le site de la revue Cell Host & Microbe.
Les pathogènes intracellulaires utilisent diverses stratégies pour contourner les défenses des cellules hôtes, et notamment des macrophages, afin de pouvoir proliférer en leur sein. Une de ces stratégies consiste à cibler les organites cellulaires tels que la mitochondrie. La principale fonction des mitochondries est de fournir de l’énergie à la cellule. Certaines bactéries, dont Legionella pneumophila, sont ainsi capables de modifier les fonctions mitochondriales pour les détourner à leur avantage.
La bactérie L. pneumophila est responsable de la légionellose, une maladie caractérisée par une infection pulmonaire aigue qui est souvent fatale si elle n’est pas traitée correctement. En France, entre 1200 et 1500 cas sont recensés chaque année avec un taux de mortalité de 5 à 15 %.
Des chercheurs de l’Institut Pasteur, du CNRS et de l’Inserm, en collaboration avec des scientifiques suisses*, ont découvert un mécanisme jusqu’alors inconnu, utilisé par L. pneumophila pour détourner les fonctions de la cellule hôte et causer ainsi le développement de la légionellose. La bactérie engendre une fragmentation de la mitochondrie, ce qui perturbe la production d’énergie et modifie, par effet domino, le métabolisme intracellulaire. Cela permet de créer un environnement local favorable à la réplication de la bactérie. Cette stratégie bactérienne a un impact important sur la virulence de L. pneumophila.
Les chercheurs ont ainsi identifié le mécanisme cellulaire suivant : L. pneumophila établit des contacts transitoires très dynamiques avec la mitochondrie de l’hôte et sécrète une enzyme appelée MitF. Cette enzyme induit une fragmentation de la mitochondrie grâce à l’activation de la protéine DNM1L. Par ce biais, et sans provoquer de mort cellulaire, la bactérie L. pneumophila perturbe la respiration mitochondriale, chaîne de réactions permettant une production d’énergie. Les changements induits par la bactérie dans la dynamique mitochondriale se traduisent par des modifcations physiologiques de la cellule hôte – cette cellule prend un phénotype de type Warburg, caractéristique des cellules cancéreuses. Elle devient alors plus permissive à la réplication de L. pneumophila.
Parallèlement, les chercheurs ont démontré que, lorsque les cellules hôtes sont préservées des dommages causés aux mitochondries, l’infection bactérienne est réduite. En effet, la réplication intracellulaire de L. pneumophila devient impossible lorsque les cellules humaines sont prétraitées par un candidat médicament inhibant les changements de morphologie mitochondriale.
Comme l’explique Carmen Buchrieser, cheffe d’équipe de l’unité de Biologie des bactéries intracellulaires de l’Institut Pasteur et du CNRS, « cette découverte est majeure, car elle permet de mettre en évidence une stratégie clé employée par L. pneumophila pour se répliquer dans les cellules. En ciblant les mitochondries, la bactérie assure un environnement favorable à sa prolifération dans la cellule hôte. Il est donc essentiel que les chercheurs ciblent aussi les changements métaboliques causés par les bactéries pathogènes, afin de développer de nouvelles stratégies thérapeutiques contre la légionellose ainsi que d’autres pathologies liées aux bactéries intracellulaires ».
Cette étude met en lumière les mécanismes moléculaires employés par les bactéries pathogènes intracellulaires pour moduler la réponse métabolique des cellules hôtes lors d’une infection. Ces changements métaboliques jouent un rôle clé dans l’évolution des maladies comme la légionellose, car ils permettent aux bactéries de se répliquer au sein des cellules. Ce travail ouvre ainsi de nouvelles perspectives pour le développement de stratégies thérapeutiques contre les maladies infectieuses, qui viseraient notamment à inhiber les changements métaboliques causés par les bactéries pathogènes
* Les équipes et chercheurs impliqués sont : Carmen Buchrieser, cheffe d’équipe de l’unité de biologie des bactéries intracellulaires (Institut Pasteur/CNRS), Hubert Hilbi de l’Université de Zürich en Suisse, Priscille Brodin au Centre d'infection et d'immunité de Lille (Institut Pasteur de Lille/CNRS/Inserm/Université de Lille), et Jean-Christophe Olivo-Marin, chef d’équipe de l’unité d’Analyse d’images biologiques (Institut Pasteur/CNRS).
Source
Legionella pneumophila modulates mitochondrial dynamics to trigger metabolic repurposing of infected macrophages, Cell Host & Microbe, 31 août, 2017
Pedro Escoll (1,2), Ok-Ryul Song (3), Flávia Viana (1,2), Bernhard Steiner (4), Thibault Lagache (5,6), Jean-Christophe Olivo-Marin (5), Francis Impens (7,8,9), Priscille Brodin (3), Hubert Hilbi (4) & Carmen Buchrieser (1,2)
(1) Institut Pasteur, Biologie des Bactéries Intracellulaires
(2) CNRS UMR 3525, Paris, France,
(3) Univ. Lille, CNRS, Inserm, CHU Lille, Institut Pasteur de Lille, U1019 – UMR 8204-CIIL-Center for Infection and Immunity of Lille, F-59000 Lille, France,
(4) Institute of Medical Microbiology, University of Zurich, Switzerland,
(5) Institut Pasteur, Unité d'Analyse d'Images Biologiques, CNRS UMR 3691, Paris, France,
(6) Present address: Department of Biological Sciences, Columbia University, 10027 New-York,
(7) VIB-UGent Center for Medical Biotechnology
(8) VIB Proteomics Core and
(9) Department of Biochemistry, Ghent University, 9000 Ghent, Belgium
DOI: 10.1016/j.chom.2017.07.020