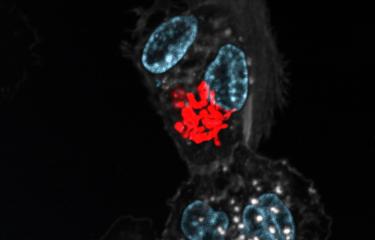
L’agent pathogène Legionella pneumophila module la biochimie de la cellule qu’elle infecte à son bénéfice. La bactérie empêche la respiration mitochondriale, tout en maintenant le potentiel de membrane des mitochondries afin de retarder la destruction de la cellule hôte.
Legionella pneumophila est un pathogène bactérien qui provoque une pneumonie grave, la légionellose, souvent mortelle lorsqu'elle n'est pas traitée rapidement. En France, entre 1200 et 2000 cas sont recensés chaque année, avec des taux de mortalité allant de 5 à 15 %. Une étude menée par des scientifiques de l’Institut Pasteur et récemment publiée dans la revue eLife montre que cette bactérie module l’action d’une enzyme cellulaire à son avantage.
Legionella cible les mitochondries de son hôte
L. pneumophila est une bactérie intracellulaire qui a développé des stratégies uniques pour proliférer dans sa cellule hôte et moduler ses défenses. De manière intéressante, L. pneumophila est une bactérie qui a la capacité de cibler différents organites de la cellule, parmi lesquels les mitochondries. Ce sont des organites intracellulaires qui ont de nombreuses fonctions importantes, et fournissent en particulier l'énergie à la cellule. Auparavant, des chercheurs de l’Institut Pasteur ont montré que L. pneumophila module la dynamique mitochondriale en induisant la fragmentation du réseau mitochondrial. Une conséquence de cette fragmentation en plusieurs mitochondries est l'altération de la respiration mitochondriale, une suite de réactions qui génère et utilise le potentiel membranaire mitochondrial pour synthétiser l’ATP. Il s’agit d’une molécule importante qui véhicule l’énergie dans la cellule pour réaliser de nombreuses autres réactions.
Cependant, une question est restée sans réponse. Malgré la fragmentation des mitochondries induite par la bactérie, les mitochondries de la cellule hôte conservent leur potentiel membranaire normal pendant l’infection. Si le potentiel membranaire mitochondrial est généré pendant la respiration dans des conditions normales, et si Legionella arrête la respiration mitochondriale, comment est-il possible que les mitochondries aient un potentiel membranaire normal en l'absence de respiration ?
Maintenir les caractéristiques des mitochondries pour préserver sa niche de réplication
Dans cette nouvelle étude, les chercheurs de l’unité Biologie des Bactéries Intracellulaires de l’Institut Pasteur mettent en évidence que l'infection à L. pneumophila modifie l'activité d’une enzyme mitochondriale, la FOF1-ATPase, pour qu’elle fonctionne en « mode inverse » au lieu du « mode avant ». Cela maintient ainsi le potentiel membranaire normal en l’absence de respiration mitochondriale. L. pneumophila est connue pour sa capacité à transférer des cocktails de protéines dans son hôte eucaryote qui modulent de nombreuses voies de défenses. Cette étude montre que l'une de ces protéines bactériennes transféré dans la cellule hôte, LpSpl, participe au processus de la modification de l'activité de la FOF1-ATPase mitochondriale.
Le changement de mode de fonctionnement de cette ATP synthase induit par les bactéries chez l’hôte conduit à une mort cellulaire retardée. En effet, une diminution du potentiel membranaire dans les mitochondries est un déclencheur de la mort cellulaire. Par conséquent, lorsque Legionella arrête la respiration mitochondriale dans la cellule, ce mécanisme maintient le potentiel et évite le déclenchement de la mort cellulaire de l'hôte. En fin de compte, cela soutient la réplication bactérienne en préservant sa niche de réplication. Ce travail contribue à enrichir notre compréhension sur la façon dont un agent pathogène module les organites de l'hôte et la fonction de leurs enzymes au cours de l'infection, permettant sa réplication de dans les cellules humaines et provoquant ainsi la maladie.
Cette étude entre dans le cadre de l’axe scientifique prioritaire Maladies infectieuses émergentes du plan stratégique 2019-2023 de l’Institut Pasteur.
Source :
Reverting the mode of action of the mitochondrial FOF1-ATPase by Legionella pneumophila preserves its replication niche, eLife, 9 décembre 2021
Pedro Escoll1,2, Lucien Platon1,2,3, Mariatou Dramé1,2,4, Tobias Sahr1,2, Silke Schmidt1,2,5, Christophe Rusniok1,2, Carmen Buchrieser1,2
1 - Institut Pasteur, Biologie des Bactéries Intracellulaires, Paris, France
2- Institut Pasteur, Biologie des Bactéries Intracellulaires and CNRS UMR 3525, Paris, France
3 - Faculté des Sciences, Université de Montpellier, Montpellier, France
4 - Faculté des Sciences, Université de Paris, Paris, France
5 - Sorbonne Université, Collège doctoral, Paris, France