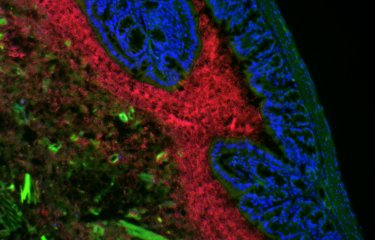
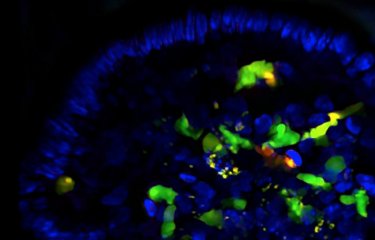
Le microbiote et la mort cellulaire des cellules de l’intestin provoquée par la chimiothérapie stimulent l’efficacité de la réponse immunitaire des patients atteints d’un cancer du côlon. C’est ce que démontrent les résultats d’une étude internationale publiée dans la revue Nature Medicine et menée en France par des chercheurs de Gustave Roussy, l’Inserm, l’Université Paris-Saclay, l’Institut Pasteur, l’IHU Méditerranée Infections et l’INRAe. Dans cette étude, les chercheurs apportent plusieurs éléments nouveaux permettant de mieux comprendre les mécanismes à l’origine des bonnes ou mauvaises réponses aux traitements anticancéreux.
Avec plus de 43 000 nouveaux cas chaque année et 17 000 décès par an, le cancer colorectal reste la deuxième cause de décès par cancer en France. Ce cancer et notamment celui du côlon droit (proximal) plus grave que celui du côlon gauche, n’a pas, à ce jour, vraiment bénéficié des deux révolutions thérapeutiques récentes en oncologie que sont l’immunothérapie et la médecine de précision. Le traitement à base d’oxaliplatine demeure le pilier thérapeutique de ce cancer digestif. Cette chimiothérapie provoque la mort cellulaire (ou apoptose) des cellules de l’intestin des patients et plus précisément de celles de l’iléon situé dans la partie terminale de l’intestin en amont du côlon droit. « Le défi était donc de comprendre les mécanismes expliquant l’inefficacité des combinaisons d’immunothérapie et d’oxaliplatine chez les patients atteints d’un cancer du côlon proximal », indique le Pr Laurence Zitvogel qui a dirigé l’étude.
Dans cet objectif, les chercheurs ont analysé les conditions qui engendrent une réponse immunitaire composée de cellules uniques dites TFH (cellules T Follicular Helper) nécessaires à l’immunisation de l’hôte contre son cancer. Chez les patients atteints d’un cancer du côlon, ils ont observé que le traitement par oxaliplatine a des effets supérieurs si deux conditions sont réunies :
- une apoptose de la crypte iléale,
- un microbiote iléal particulier caractérisé par la présence de bactéries immunogènes (comme B. fragilis ou E. ramosum).
Ces deux conditions sont associées aux TFH qui sont les cellules qui éduquent les lymphocytes B et permettent de s’immuniser contre son cancer. « Dans le cas contraire, la mort des cellules de la crypte de l’iléon provoquée par l’oxaliplatine en présence d’une flore intestinale enrichie en certaines espèces bactériennes tolérogènes est associée à une passivité du système immunitaire et au mauvais pronostic des patients », précise le Pr Zitvogel.
« En particulier, nous montrons que l’activation de l’immunité innée par certaines bactéries du microbiote, via leurs structures de surface, est essentielle pour induire une réponse immunogène contre la tumeur, alors que d’autres membres du microbiote induisent une tolérance délétère au traitement antitumoral », explique, Ivo Gomperts-Boneca, co-auteur de l’étude, et responsable de l’unité de Biologie et génétique de la paroi bactérienne, à l’Institut Pasteur.
Dans cette étude, l’importance du microbiote et de la mort cellulaire dans l’efficacité du traitement par oxaliplatine a été démontrée dans des modèles murins dont le microbiote a été supprimé par un traitement antibiotique ou dans lesquels la mort cellulaire n’était plus possible.
Les chercheurs ont aussi montré dans ces modèles de vaccination par des cellules de l’intestin en apoptose (traitées à l’oxaliplatine) que l’efficacité du vaccin peut être modulée par l’ajout de bactéries immunogènes telles B. fragilis ou E. ramosum qui engendrent une réponse immunitaire TFH et lymphocytaire B efficace.
Ils ont également montré, dans des modèles murins de cancer du côlon qui n’ont pas de mutation et par conséquent qui ne répondraient pas normalement aux anticorps anti-PD1, que la compensation du microbiote par des bactéries immunogènes (B. fragilis ou E. ramosum) rétablit le bénéfice d’un traitement par immunothérapie par anti-PD1.
L’ensemble de ces résultats démontrent le rôle important de l’iléon (et non du côlon) dans le pronostic des cancers du côlon, et en particulier du microbiote et de la mort cellulaire iléaux (et non coliques) dans la bonne réponse aux traitements anticancéreux des cancers coliques graves (proximaux). Ils ouvrent également de nombreuses perspectives sur de nouvelles stratégies. « Dans l’avenir, nous pourrions vacciner les patients ayant une maladie génétique prédisposant au cancer du côlon comme la maladie de Lynch avec leurs propres cellules intestinales en boostant leur efficacité par des bactéries immunogènes. Dans un premier temps, dans le cadre d’un essai clinique qui inclura 40 malades atteints d’un cancer du côlon droit métastatique et traités par immunothérapie et chimiothérapie, nous allons développer des organoïdes d’iléons humains aussi appelés entéroïdes, pour approfondir nos connaissances sur les paramètres microbiens et immuns qui dictent l’efficacité des traitements », conclut le Pr Zitvogel.
Cette étude a bénéficié du soutien de :
- Ligue Contre le Cancer
- Agence Nationale de la Recherche - RHU Torino Lumière (ANR-16-RHUS-0008)
- H2020 ONCOBIOME
- Institut National Du Cancer
- Cancéropôle Ile-de-France
- Institut Universitaire de France
- the LabEx Immuno-Oncology
- the Seerave Foundation;
- SIRIC SOCRATE
- SIRIC Cancer Research and Personalized Medicine (CARPEM)
- FHU CARE
- Groupe Dassault
- Paris Alliance of Cancer Research Institutes (PACRI)
- Elisabeth Badinter
- ITMO Cancer AVIESAN (Alliance Nationale pour les Sciences de la Vie et de la Santé)
- Centre National de la Recherche Scientifique
Source
Chemotherapy-induced Ileal Crypt Apoptosis and the Ileal Microbiome Shape Immunosurveillance and Prognosis of Proximal Colon Cancer, Nature Medicine, 25 mai 2020 - doi : 10.1038/s41591-020-0882-8
Maria Paula Roberti1-3, Satoru Yonekura1,2,4, Connie P.M. Duong1,2, Marion Picard1,2,5, Gladys Ferrere1,2, Maryam Tidjani Alou1,2, Conrad Rauber1,2,4, Valerio Iebba1,2, Christian H.K. Lehmann6, Lukas Amon6, Diana Dudziak6, Lisa Derosa1-3, Bertrand Routy1,2,4, Caroline Flament1-3, Corentin Richard7,8, Romain Daillère1,2, Aurélie Fluckiger1,2, Isabelle Van Seuningen9, Mathias Chamaillard10, Audrey Vincent9, Stephanie Kourula11,12, Paule Opolon1, Pierre Ly1,2, Eugénie Pizzato1,2, Sonia Becharef1,2, Juliette Paillet4,13,14, Christophe Klein13, Florence Marliot15,16, Filippo Pietrantonio17,18, Stéphane Benoist19, Jean-Yves Scoazec20, Peggy Dartigues20, Antoine Hollebecque21, David Malka21, Franck Pagès15,16, Jérôme Galon15,16, Ivo Gomperts Boneca5,22, Patricia Lepage23, Bernard Ryffel24, Didier Raoult25, Alexander Eggermont1,2,21, Tom Vanden Berghe11,12, François Ghiringhelli7,8, Peter Vandenabeele11,12,26, Guido Kroemer13,14,27-29, and Laurence Zitvogel1-4,28
1 Gustave Roussy Cancer Campus (GRCC), 94800 Villejuif, France.
2 Institut National de la Santé Et de la Recherche Medicale (INSERM) U1015, Equipe Labellisée—Ligue Nationale contre le Cancer, 94800 Villejuif, France.
3 Center of Clinical Investigations in Biotherapies of Cancer (CICBT) 1428, 94800 Villejuif, France.
4 Univ. Paris-Sud, Université Paris-Saclay, Gustave Roussy, Villejuif, France.
5 Institut Pasteur Paris, Unit Biology and Genetics of the bacterial Cell Wall, 75015 Paris, France.
6 Department of Dermatology, Laboratory of Dendritic Cell Biology, Medical Immunology Campus Erlangen, University Hospital of Erlangen, Friedrich-Alexander-University (FAU) of Erlangen-Nürnberg, 91052 Erlangen, Germany.
7 Department of Medical Oncology, Center GF Leclerc, 21000 Dijon, France.
8 Plateform transfer in biological Oncology, 21000 Dijon, France.
9 Univ. Lille, Inserm, CHU Lille, UMR-S 1172 - JPARC - Jean-Pierre Aubert Research Center F-59000 Lille, France.
10 Univ. Lille, Inserm U1003 - PHYCEL - Physiologie Cellulaire, F-59000 Lille, France.
11 Molecular signaling and Cell Death Unit, VIB Inflammation Research Center, Ghent, Belgium.
12 Department of Biomedical Molecular Biology, Ghent University, 9000 Ghent, Belgium.
13 Equipe labellisée par la Ligue contre le cancer, Université de Paris, Sorbonne Université, INSERM U1138, Centre de Recherche des Cordeliers, Paris, France
14 Cell Biology and Metabolomics Platforms, Gustave Roussy Cancer Campus, Villejuif, 94805, France
15 Laboratory of integrative cancer immunology, INSERM U1138, Centre de Recherche des Cordeliers, 75006 Paris, France.
16 Service d’Immunologie Biologique, hôpital européen Georges Pompidou, 75005 Paris, France.
17 Medical Oncology Department, Fondazione IRCCS Istituto Nazionale dei Tumori, 20113 Milan, Italy.
18 Department of Oncology and Hemato-oncology, university of Milan, 20122 Milan, Italy.
19 Service de Chirurgie Digestive et Oncologique, Hôpital Bicêtre, 94270 Le Kremlin-Bicêtre, France.
20 Departement de Biologie et Pathologie Médicales, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
21 Departement de Médicine Oncologique, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
22 INSERM, Equipe Avenir, Paris, France
23 Micalis Institute, INRA, AgroParisTech, Université Paris-Saclay, 78350 Jouy-en-Josas, France.
24 Molecular Immunology and Embryology, UMR 7355, CNRS, University of Orleans, Orléans, France.
25 Unité des Rickettsies, Faculté de Médecine, Université de la Méditerranée, Marseille, 13000 France.
26 Methusalem Program, Ghent University, 9000 Ghent, Belgium.
27 Pôle de Biologie, Hôpital Européen Georges Pompidou, Assistance Publique—Hôpitaux de Paris, Paris, France.
28 Suzhou Institute for Systems Medicine, Chinese Academy of Medical Sciences, Suzhou, China
29 Department of Women’s and Children’s Health, Karolinska University Hospital, 17176 Stockholm, Sweden
Cette étude entre dans le cadre de l’initiative Cancer du plan stratégique 2019-2023 de l’Institut Pasteur.