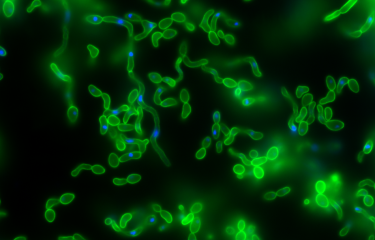
Les vésicules membranaires (également appelées vésicules extracellulaires) sont produites par toutes sortes d’organismes. Ce sont de petits sacs lipidiques qui s’échappent d’une cellule donneuse et sont internalisés par une cellule receveuse. Les vésicules servent au transport d’informations biologiques et sont décrites comme des acteurs clés de la communication intercellulaire. Leur rôle dans le monde des microbes reste cependant méconnu. Des chercheurs de l’Institut Pasteur et de l’Arizona State University (ASU) ont étudié les mouvements des vésicules membranaires dans une population bactérienne.
Bien qu’étrangères à beaucoup, les vésicules membranaires (VM) sont pourtant utilisées actuellement pour envelopper l’ARN messager codant la protéine Spike dans le vaccin tant attendu contre la Covid-19. La taille de leurs nanoparticules permet leur dissémination à travers de nombreux types de tissus, ouvrant de nouvelles perspectives passionnantes d’application dans la conception de traitements et de vaccins.
Des recherches approfondies et des découvertes remarquables dans le domaine du transport et des fonctions des VM dans les cellules eucaryotes ont été récompensées par le prix Nobel de physiologie ou médecine en 2013. Les confirmations expérimentales de l’importance des VM dans le monde des microbes sont cependant insuffisantes, et les aspects dynamiques restent inexplorés.
Un travail sans précédent né d’une découverte fortuite
« Je n’étais pas en quête de vésicules membranaires la première fois que je les ai visualisées et capturées au microscope », explique Julia Bos, ingénieure de recherche dans l’unité Plasticité du génome bactérien de l’Institut Pasteur (Paris). « Depuis le début de ma carrière, je fais l’acquisition d’images de toute une palette de souches bactériennes dans le but de décrypter les mécanismes sous-tendant l’émergence de la résistance aux antibiotiques... mais mes yeux n’avaient jamais saisi de vésicules membranaires ! Je les ai découvertes par hasard, grâce à une quantité adaptée de colorant, à un heureux grossissement et au réglage fin du microscope. » Julia Bos a, en effet, observé des sacs membranaires se déplaçant de manière aléatoire à la surface de bactéries E. coli filamenteuses « attaquées » par de faibles doses d’antibiotiques.
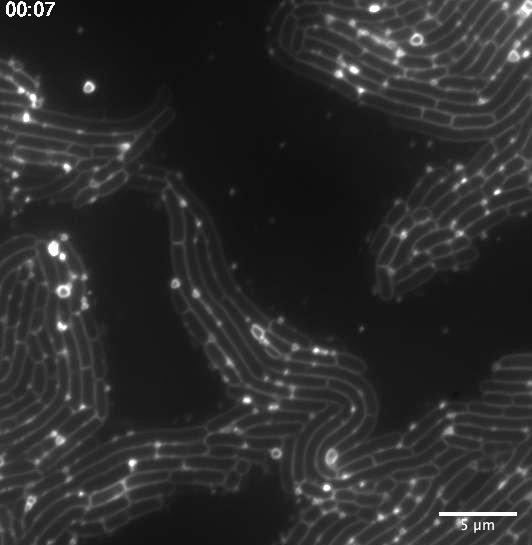
Une réponse à un stress induit par les antibiotiques à l’origine des mouvements accrus des vésicules membranaires ?
Après sa découverte, Julia Bos, Didier Mazel, responsable de son groupe de recherche, et Luis Cisneros, enseignant au Beyond Center de l’ASU, à Tempe (États-Unis), ont étudié le mécanisme observé. La microscopie à fluorescence leur a permis d’obtenir une image quantitative de la dispersion des vésicules membranaires et de leur emplacement au sein d’une population bactérienne. Selon eux, les propriétés motrices des VM pourraient traduire un stress induit par les antibiotiques.
« Il y a tant à découvrir encore au regard de la diversité des espèces microbiennes et de l’hétérogénéité de la taille et de la composition des vésicules », conclut Julia Bos. Ce travail offre un éclairage passionnant sur les vésicules membranaires et leur rôle dans le monde des microbes.
Source
Real-time tracking of bacterial membrane vesicles reveals enhanced membrane traffic upon antibiotic exposure, Science Advances, 20 janvier 2021
Julia Bos1*†, Luis H. Cisneros2*†, Didier Mazel1
1 Unité Plasticité du génome bactérien, Institut Pasteur, UMR3525, CNRS, Paris 75015, France.
2 Biodesign Center for Biocomputing, Security and Society et BEYOND Center for Fundamental Concepts in Science, Arizona State University, Tempe, AZ, États-Unis.
† Auteur correspondant. E-mail : julia.bos@pasteur.fr (J.B.) ; lhcisner@asu.edu (L.H.C.).
* Ces auteurs ont contribué de manière équivalente