Les bactéries pathogènes synthétisent différentes molécules susceptibles d'être reconnues par le système immunitaire inné. Ces molécules associées aux pathogènes déclenchent une réponse inflammatoire en stimulant des voies de signalisation spécifiques dans les cellules immunitaires infectées. Des scientifiques de l’Institut Pasteur et du CNRS, en collaboration avec l'University of Massachusetts Medical School, ont montré que le streptocoque du groupe B dégradait l'une de ces molécules pour contrôler la réponse inflammatoire de l'hôte infecté. Ces travaux, publiés dans Cell Host and Microbe le 13 juillet 2016, permettent une meilleure compréhension du dialogue entre la bactérie et les cellules immunitaires lors du processus infectieux.
Lors des infections microbiennes, le système immunitaire inné est notre première ligne de défense. Les étapes initiales de cette réponse immune impliquent la reconnaissance de molécules spécifiques aux microbes. Les cellules vont ainsi pouvoir répondre de manière coordonnée en fonction du type de microbes rencontrés pour éliminer cette menace. Cependant, certains pathogènes ont développé des mécanismes de défense pour éviter d’être reconnus par le système immunitaire.
L’interféron de type I est une des molécules produites par le système immunitaire en réponse aux infections microbiennes. Plus connu pour son rôle lors des infections virales, l’interféron de type I est également nécessaire pour lutter contre des infections causées par certaines espèces bactériennes. C’est le cas lors des infections par le streptocoque du groupe B (SGB), une bactérie responsable d’infections invasives chez les nouveau-nés.
Les chercheurs de l’unité Biologie des bactéries pathogènes à Gram-positif, dirigée par Patrick Trieu-Cuot (Institut Pasteur/CNRS), en collaboration avec des chercheurs de l’Université du Massachusetts, ont découvert un nouveau mécanisme permettant à une bactérie de limiter la production d’interféron par les cellules immunitaires infectées. La production d’interféron après infection par le SGB est principalement dépendante de la reconnaissance par les cellules de deux types de molécules libérées par les bactéries : l’ADN bactérien et le di-AMP cyclique, un nucléotide particulier dit de signalisation qui contrôle l'activité de nombreuses fonctions essentielles de la bactérie. Les chercheurs ont caractérisé une enzyme localisée à la surface du SGB, appelée CdnP, qui hydrolyse son propre di-AMP cyclique relargué dans le cytoplasme des cellules immunitaires. Ainsi, CdnP contrôle la production d’interféron et contribue à la virulence de ce pathogène.

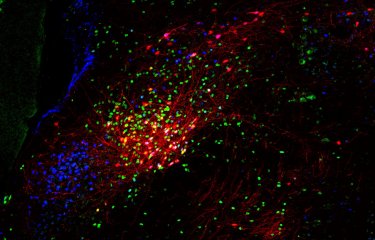
Macrophages infectés par un streptocoque du groupe B. L’échantillon a été observé en en microscopie à fluorescence. Les filaments d’actine du macrophage sont colorés en vert et les bactéries en rouge. © Institut Pasteur / E. Davenas et P. Trieu-Cuot
Ce mécanisme original qui permet à une bactérie de dégrader ses propres molécules pour éviter d’être reconnue par le système immunitaire pourrait être présent chez d’autres pathogènes. Bloquer ce mécanisme de camouflage avec de nouveaux antimicrobiens permettrait une reconnaissance et une élimination plus rapide des bactéries invasives par le système immunitaire.
Ces travaux sont soutenus par l’Institut Pasteur et le CNRS et bénéficient en outre de financements de la FRM et du Labex « IBEEID ».
Source
Group B Streptococcus Degrades Cyclic-di-AMP to Modulate STING-Dependent Type I Interferon Production, Cell Host and Microbe, 13 juillet 2016.
Warrison A. Andrade,1,2,6 Arnaud Firon,3,4,6 Tobias Schmidt,5 Veit Hornung,5 Katherine A. Fitzgerald,1,2 Evelyn A. Kurt-Jones,1,2 Patrick Trieu-Cuot,3,4 Douglas T. Golenbock,1,2,7 and Pierre-Alexandre Kaminski,3,4,7
1Division of Infectious Diseases and Immunology
2Program in Innate Immunity Department of Medicine, University of Massachusetts Medical School, Worcester, MA 01605, USA
3Institut Pasteur, Unité de Biologie des Bactéries Pathogènes à Gram-Positif, 75724 Paris, France
4Centre National de la Recherche Scientifique (CNRS) ERL 3526, 75724 Paris, France
5Institute of Molecular Medicine, Universitätsklinikum Bonn, Bonn 53127, Germany
6Co-premier auteur
7Co-senior auteur
Mis à jour le 13/07/2016