Lorsque le cancer échappe à notre système immunitaire celui-ci se retrouve démuni et dans l’incapacité de combattre la maladie. Les cellules CART (Chimeric Antigen Receptor T cells) représentent une immunothérapie prometteuse, développée dans le but d’attaquer frontalement la tumeur. Néanmoins la survenue de rechutes chez certains patients reste un défi. Des chercheurs de l’Institut Pasteur ont disséqué le fonctionnement précis des cellules CAR T dans le but d’optimiser les futures thérapies.
Une des stratégies de lutte contre les cancers est basée sur la modification des lymphocytes T (appelés aussi cellules tueuses) du patient afin qu’elles reconnaissent la molécule cible CD19 exprimée par la tumeur pouvant ainsi l’éliminer. Les essais cliniques ont démontré une efficacité remarquable et ont abouti sur son utilisation chez l’adulte et l’enfant pour le traitement des cancers du sang (lymphomes et leucémies B). Pourtant, certains patients rechutent. Pour améliorer les thérapies à venir, des chercheurs de l’Institut Pasteur se sont intéressés au fonctionnement précis des cellules CAR T.
Voyage au cœur de l’immunité
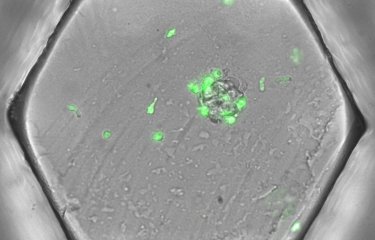
Marine Cazaux et Capucine Grandjean ainsi que leurs collègues de l’unité Dynamiques des réponses immunes (Institut Pasteur / Inserm), dirigée par Philippe Bousso, et en collaboration avec des scientifiques des universités de Manchester (UK) et de Leiden (NL), ont visualisé pour la première fois les cellules CAR T en plein champ de bataille au sein de la tumeur. En effet, ils ont observé, grâce à une technique innovante d’imagerie in vivo haute résolution, la moelle osseuse de souris atteintes de lymphome. Ainsi, ils ont pu étudier le comportement des cellules CAR T dans sa globalité et sont parvenus à visualiser en temps réel les interactions entre les cellules CAR T et la tumeur ainsi que la mort de cette dernière (visualisée par une technique ingénieuse de changement de couleur de la cellule cancéreuse suite à sa mort). Même si certaines cellules CART sont plus actives que d’autres, ils ont montré que dans l’ensemble, une cellule CAR T a la capacité d’induire la mort directe d’une cellule tumorale en 25 minutes environ, suivant la reconnaissance de sa cible.
Visualisation des cellules CART en action. Les cellules CART (vert) infiltrent la tumeur (blanc). Les cellules cancéreuses tuées par les cellules CART apparaissent en bleu. Crédit : Institut Pasteur
Les cellules CART, un rôle clé dans la lutte tumorale
« Les simulations mathématiques reposant sur nos données expérimentales confirment que l’efficacité des cellules CART repose principalement sur leur capacité à engager et tuer directement la cellule cancéreuse plutôt que sur le recrutement d’autres cellules immunitaires au site tumoral » explique Philippe Bousso. Ces simulations soulignent aussi que le nombre de cellule CAR T qui parvient à infiltrer la moelle osseuse joue un rôle majeur dans l’efficacité du traitement.
Un obstacle majeur à cette infiltration est la rencontre dans la circulation sanguine des cellules CAR T avec celles tumorales mais aussi avec les lymphocytes B qui expriment aussi la cible CD19. En effet, l’équipe a observé que les cellules CAR T formaient des agrégats cellulaires se retrouvant séquestrés dans la circulation pulmonaire, empêchant leur migration au site tumoral. Ainsi, réduire la quantité de cellules exprimant CD19 avant l’injection des cellules CAR T améliorait significativement la survie globale des souris.
Leurs travaux ont aussi montré qu’il existait également des différences d’activité selon les sites anatomiques. En effet, l’activité des CAR T était plus forte dans la moelle osseuse que dans les autres sites tumoraux (ex. ganglions) parvenant ainsi à exercer une pression de sélection sur les cellules tumorales avec l’émergence de cellules n’exprimant plus CD19.
« En identifiant les forces et les faiblesses des cellules CAR T en action, ces travaux offrent de nouvelles pistes pour exploiter et optimiser l’activité des cellules CAR T chez les patients » conclut Philippe Bousso.
Source
Single-cell imaging of CAR T cell activity in vivo reveals extensive functional and anatomical heterogeneity, Journal of Experimental Medicine, April 1st, 2019
Marine Cazaux*,1,2, Capucine L. Grandjean*,1, Fabrice Lemaître1 , Zacarias Garcia1 , Richard J. Beck3, Idan Milo1, Jérémy Postat1,2, Joost B. Beltman3, Eleanor J. Cheadle4 and Philippe Bousso1
* These authors contributed equally to this work.
1 Dynamics of Immune Responses Unit, Equipe Labellisée Ligue Contre le Cancer, Institut Pasteur, INSERM U1223, Paris, France.
2 University Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, France.
3 Division of Drug Discovery and Safety, Leiden Academic Centre for Drug Research, Leiden University, Leiden, Netherlands
4 Targeted Therapy Group, Manchester Cancer Research Centre, Division of Cancer Sciences, School of Medical Sciences, Faculty of Biology, Medicine and Health, The University of Manchester, Manchester Academic Health Sciences Centre, Wilmslow Road, Manchester, United Kingdom
Cette étude entre dans le cadre de l’initiative Cancer du plan stratégique 2019-2023 de l’Institut Pasteur.