C’est la disparition d’un glycolipide de l’enveloppe bactérienne, au cours de l’évolution, qui aurait considérablement augmenté la virulence des bacilles de la tuberculose chez l’Homme. Des chercheurs du CNRS, de l’Institut Pasteur et de l’université Toulouse III – Paul Sabatier[1] ont montré que cette disparition a entrainé une modification des propriétés de surface de Mycobacterium tuberculosis, favorisant son agrégation en « corde », et augmentant sa pathogénicité. Ces résultats, qui permettent de mieux connaitre les mécanismes liés à l’évolution et à l’émergence des bacilles de la tuberculose, sont une avancée majeure dans la compréhension de cette maladie. Ils sont publiés dans la revue Nature Microbiology le 27 janvier 2016.

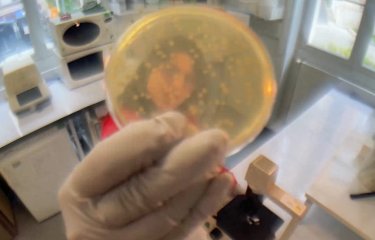
Sur milieu de culture solide, les colonies de M. canettii sont muqueuses et collantes alors que celles de M. tuberculosis sont sèches, rugueuses et fripées © Roland Brosch, Institut Pasteur.
La tuberculose est une maladie bactérienne chronique causée par l’agent infectieux Mycobacterium tuberculosis. En 2014, 9,6 millions de cas de tuberculose et 1,5 million de décès ont été recensés dans le monde, classant cette maladie au second rang des causes de décès dus à un agent infectieux unique (OMS, 2015). Pour combattre cette maladie, il est nécessaire de mieux comprendre les facteurs et mécanismes favorisant sa propagation.
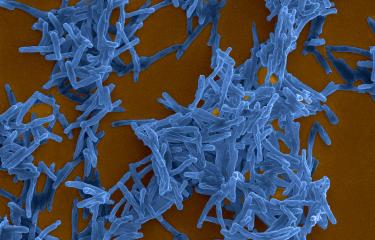
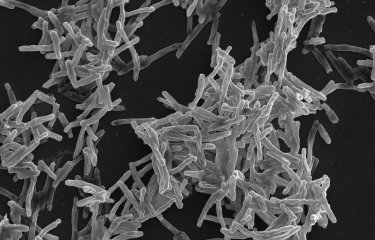
Les étapes évolutives, et adaptations génétiques associées, qui ont permis aux bacilles de la tuberculose de coloniser l’Homme restent peu connues à l’inverse d’autres maladies infectieuses comme la peste ou le typhus. Pour aborder cette question, les chercheurs se sont intéressés à un autre type de bacille, Mycobacterium canettii, connu pour causer de rares cas de tuberculose et pour être génétiquement proche de l’ancêtre de M. tuberculosis. Les chercheurs ont observé que les colonies[2] de ces bactéries sont très différentes de celles des bacilles de la tuberculose. Alors que sur milieu solide les colonies de M. tuberculosis sont sèches, rugueuses et fripées, celles de M. canettii sont muqueuses et collantes. Dans un milieu de culture liquide, les premières sont fortement agrégées en forme de corde alors que les secondes se désolidarisent complétement.
En étudiant des mutants spontanés de M. canettii formant des colonies fripées, les chercheurs ont montré que le changement d’aspect des colonies a été provoqué par une recombinaison entre deux gènes impliqués dans la production d’un glycolipide de l’enveloppe bactérienne. En étudiant précisément l’organisation génétique de cette région chez les bacilles de la tuberculose, les scientifiques ont pu démontrer qu’une recombinaison similaire s’était produite chez l’ancêtre de M. tuberculosis. Cette recombinaison conduit à l’inactivation de la voie de biosynthèse du glycolipide et donc à sa disparition à la surface des bacilles. Les chercheurs ont montré que cette disparition induit chez M. canettii une modification des propriétés de surface et favorise ainsi son agrégation en « corde », de la même manière que chez M. tuberculosis. Enfin, en utilisant différents modèles animaux et cellulaires de l’infection, les chercheurs ont établi que cette modification de l’enveloppe bactérienne provoque un changement des interactions avec les cellules de défense de l’hôte et une augmentation de la virulence de M. canettii.
Cette découverte constitue une étape essentielle dans la compréhension de l’origine et de l’émergence du bacille de la tuberculose. Les chercheurs vont continuer à étudier M. canettii et M. tuberculosis afin de déterminer les facteurs bactériens et les réponses immunitaires induites par ces facteurs qui ont contribué au succès de M. tuberculosis en tant que pathogène majeur de l’homme.
Source
Pks5 recombination-mediated surface remodelling in Mycobacterium tuberculosis emergence, Nature Microbiology, le 27 janvier 2016. DOI : NMICROBIOL.2015.19
Eva C. Boritsch, Wafa Frigui, Alessandro Cascioferro, Wladimir Malaga, Gilles Etienne, Françoise Laval, Alexandre Pawlik, Fabien Le Chevalier, Mickael Orgeur, Laurence Ma, Christiane Bouchier, Timothy P. Stinear, Philip Supply, Laleh Majlessi, Mamadou Daffé, Christophe Guilhot, et Roland Brosch.
[1] De l’Institut de pharmacologie et de biologie structurale (CNRS/Université Toulouse III - Paul Sabatier), de l’Unité Pathogénomique mycobactérienne intégrée de l’Institut Pasteur et du Centre d'infection et d'immunité de Lille (CNRS/Inserm/Université de Lille) ainsi qu’un chercheur de l’université de Melbourne.
[2] Une colonie est une masse de cellules ou de micro-organismes, qui se développe dans un milieu de culture. Ce milieu peut être solide ou liquide.