De la biologie moléculaire aux cellules souches

Mai 1968. Tandis que le mouvement étudiant bat le pavé parisien, Jacques Monod et François Jacob préparent ce qui deviendra un tournant décisif pour l’Institut Pasteur : l’ouverture d’un nouveau département consacré à la biologie moléculaire, c’est-à-dire à l’étude des mécanismes moléculaires qui orchestrent la vie des cellules. Le projet, qui vient d’être approuvé par le conseil d’administration de l’institut et prévoit la construction d’un bâtiment dédié, est dans la droite ligne de la découverte qui leur a valu le prix Nobel en 1965 avec André Lwoff. Dans les années 1950, à une époque où l’on commençait à comprendre comment les gènes, ces éléments des chromosomes porteurs chacun d’un caractère héréditaire précis, commandent la synthèse des protéines, molécules clés du fonctionnement des organismes vivants, les trois biologistes pasteuriens ont mis en évidence l’existence de mécanismes de régulation de l’expression des gènes : ils ont montré comment, à leur tour, les protéines régulent l’activité des gènes (voir l’encadré ci-dessous). Vouer un département à l’étude de ces mécanismes de régulation découverts chez la bactérie, mais qui, disait Jacques Monod, étaient valables « tant pour la bactérie que pour l’éléphant », leur semblait donc tout naturel et essentiel.
Lwoff, Monod, Jacob : trois pasteuriens participent à la fondation de la biologie moléculaire


En 1965, le prix Nobel de physiologie ou médecine a été attribué à André Lwoff, Jacques Monod et François Jacob « pour leurs découvertes concernant le contrôle génétique de la synthèse des enzymes et des virus ». Ces découvertes tiennent en un mot : opéron – le nom du système de régulation de l’activité des gènes que les trois biologistes de l’Institut Pasteur et leurs collègues ont mis au jour dans le « grenier », la centaine de mètres carrés sous les toits du bâtiment Duclaux qui leur servait de laboratoire.
À la fin des années 1950, on savait depuis peu que, dans les cellules, la molécule d’ADN est le support des gènes, ces informations identitaires qui se transmettent d’une génération à la suivante. On avait aussi compris que les gènes jouent un rôle essentiel dans la détermination des caractéristiques des organismes vivants. Mais une interrogation persistait : comment des cellules qui portent les mêmes gènes peuvent-elles avoir des fonctions différentes ? Lwoff, Jacob et Monod ont résolu ce paradoxe en introduisant la notion de gène régulateur. En rapprochant deux phénomènes observés l’un dans des cultures de bactéries, l’autre lors de l’infection de bactéries par leur virus, le bactériophage, les biologistes ont montré que les gènes d’une cellule ne sont pas constamment actifs. Leur activité dépend d’autres gènes, dits régulateurs, qui codent des protéines, lesquelles vont réprimer ou au contraire activer des groupes de gènes impliqués dans une même fonction – la digestion d’un sucre, par exemple. L’opéron est le nom que Jacob et Monod ont donné à l’ensemble des gènes soumis à une même régulation. Cette découverte a contribué à révolutionner la biologie en la faisant entrer dans l’ère moléculaire.
François Jacob s’attaque aux eucaryotes
De fait, à l’ouverture du département, la plupart des unités se concentrent sur la régulation de l’expression des gènes. Plusieurs équipes continuent à l’explorer chez les bactéries, mais François Jacob peut enfin mettre en application une aspiration qu’il porte depuis longtemps : étudier ces mécanismes chez des organismes plus complexes, les eucaryotes, constitués de cellules à noyaux – en particulier les animaux (dont l’humain). François Jacob est persuadé que des mécanismes similaires à ceux observés chez la bactérie sont à l’œuvre chez ces organismes et qu’ils sont la clé de l’énigme du développement embryonnaire : à partir d’une cellule unique, un organisme complexe se développe, avec de multiples organes aux caractéristiques et fonctions variées. Comment une telle différenciation des cellules est-elle possible ?
Toutefois, à l’époque, les outils pour étudier le développement embryonnaire et la différenciation cellulaire sont limités. On sait conserver quelques jours en culture un embryon précoce de souris, à un stade où il ne comporte que quelques cellules, mais ce système reste très insuffisant pour étudier ce qui se passe à l’échelle d’un tissu, par exemple. Néanmoins, une découverte réalisée dans les années 1950-1960 attire l’attention de François Jacob : deux Américains, Leroy Stevens et Barry Pierce, ont sélectionné une lignée de souris qui produisent spontanément dans leurs testicules un type de tumeur particulier nommé tératocarcinome. Ces tumeurs contiennent toutes sortes de types cellulaires – des neurones, des cellules musculaires, des cellules de peau, etc. – sans aucune organisation. Or, Leroy Stevens et Barry Pierce ont montré que ces tumeurs sont transplantables : même une seule cellule de la tumeur peut donner naissance à un tératocarcinome chez une autre souris. La tumeur contient donc des cellules capables de se différencier en plusieurs types cellulaires, comme les cellules de l’embryon. Les deux biologistes venaient de prouver l’existence de ce que l’on nommerait ensuite des cellules souches pluripotentes (ici issues d’une tumeur).

Shahragim Tajbakhsh, chef de l’unité Cellules souches et développement à l’Institut Pasteur
Avec la création du département de biologie moléculaire à l’Institut Pasteur, François Jacob et Jacques Monod ont axé leurs recherches sur les gènes et leur régulation à l’échelle des cellules, des tissus.
Des contributions clés qui ont consolidé la discipline
Peu à peu, des embryologistes tels que Boris Ephrussi, au sein du tout nouveau Centre de génétique moléculaire du CNRS, à Gif-sur-Yvette, ont isolé ces cellules souches et démontré leur potentiel pour étudier la différenciation et les premiers stades de l’embryogenèse. François Jacob emprunte alors à Boris Ephrussi les lignées cellulaires qu’il a produites, et son savoir-faire. Au cours des années 1970, son équipe – notamment Charles Babinet, Philippe Brûlet, Jean-François Nicolas, Philip Avner et Jean-Louis Guénet –, puis d’autres en Grande-Bretagne et aux États-Unis, établissent ainsi des lignées de cellules cultivables et capables de produire toutes sortes de tissus : cellules cardiaques, musculaires, nerveuses, de la peau…
Les débuts sont difficiles, car même si l’équipe de François Jacob dispose désormais d’un système pour étudier la différenciation des cellules en culture, les outils manquent pour comprendre ce qui se passe dans ces cellules à l’échelle moléculaire. Le constat est le même pour François Gros, qui a rejoint le département pour s’intéresser en particulier, avec Margaret Buckingham, aux cellules formant le muscle squelettique. Mais à partir de la fin des années 1970, l’introduction des techniques de biologie moléculaire change la donne : il devient possible d’isoler des gènes codant des protéines spécifiques, d’étudier leur position dans le chromosome chez l’homme et la souris et leur expression durant la différenciation, et de commencer à étudier les mécanismes de régulation de leur expression.
L’équipe d’Henri Buc a effectué des études d’enzymologie, de physicochimique, et des interactions protéines-ADN afin de comprendre les mécanismes régulateurs de l’expression génique. Ces études ont été complémentées par l’équipe de Daniel Louvard qui a exploré et poussé la discipline de la biologie cellulaire dans le département.

Pendant ce temps, les recherches sur la régulation des gènes se sont poursuivies dans les modèles unicellulaires de bactéries et de levures par Anthony Pugsley et Bernard Dujon, respectivement, et ces efforts ont complété les études de régulation des gènes des organismes plus complexes. De plus, la génétique de la levure a fourni de nouveaux outils qui ont été essentiels, ensuite, pour les études de la génomique chez les eucaryotes.
Des études de base sur la biologie du développement ont été menées par plusieurs équipes à partir de la fin des années 1980. Les laboratoires de Charles Babinet et Philippe Brûlet ont été les pionniers de la transgénèse et des techniques de recombinaison homologues chez la souris dans l’institut. Le laboratoire de Margaret Buckingham a également utilisé des souris génétiquement modifiées pour explorer le rôle des gènes structurels et régulateurs dans le développement du muscle squelettique et cardiaque, en mettant l’accent sur l’embryogénèse. Le laboratoire de Jean-Louis Guénet a utilisé la puissance de la génétique classique chez la souris pour identifier les loci et les gènes responsables de phénotypes spécifiques. Le laboratoire de Jean-François Nicolas a d’abord étudié la différenciation des cellules de carcinome embryonnaire, puis a utilisé des outils moléculaires innovants pour marquer et suivre des lignages cellulaires spécifiques chez l’embryon. Le laboratoire de Philip Avner était un pionnier dans l’identification des mécanismes régulant l’inactivation de chromosomes X, ainsi que pour l’épigénétique chez la souris. Collectivement, ces chercheurs ont poursuivi des questions fondamentales dans la régulation des gènes et l’organisation des tissus. Ces contributions clés ont consolidé une discipline qui se poursuit aujourd’hui.
Des mouches, des souris… et des hommes
À l’Institut Pasteur, le moment est venu d’aborder enfin le développement de l’organisme dans son ensemble. Pour comprendre la différenciation cellulaire, il est en effet indispensable d’étudier in vivo, dans l’organisme entier, comment les cellules interagissent et coopèrent pour former différents tissus selon un plan organisé. De fait, dans le monde, les recherches sur le développement ont explosé.
D’une part, depuis le début des années 1980, grâce à Martin Evans et ses collègues, de l’université Cardiff, en Grande-Bretagne, il est désormais possible d’extraire des cellules souches d’embryons de souris saines et de les cultiver en les conservant dans cet état indifférencié. L’équipe a même réussi à modifier génétiquement ces cellules souches et à générer des souris à partir d’elles. Ces avancées ont fourni un outil précieux pour les biologistes du développement : les souris transgéniques. C’est d’ailleurs avec l’aide de cette technique que Mario Capecchi, alors à l’université d’Utah, a produit des souris dont un gène cible était éteint. Ces souris « knock-out » se sont vite répandues dans les laboratoires (technologie de recombinaison homologue) et ont valu à leur co-inventeur Oliver Smithies de partager le prix Nobel de 2007 avec Martin Evans.
D’autre part, la description des gènes impliqués dans le développement a commencé. Chez la mouche, Edward Lewis, de l’Institut californien de technologie, Christiane Nüsslein-Volhard et Eric Wieschaus, tous deux du Laboratoire européen de biologie moléculaire (EMBL), à Heidelberg, en Allemagne, et leurs collègues ont répertorié de nombreux gènes jouant un rôle crucial dans le développement. Ces travaux, menés à la fin des années 1970, ont été récompensés du prix Nobel en 1995. Et, en 1983, les équipes de Walter Gehring, de l’université de Bâle, en Suisse, et de David Hogness, de l’université de Stanford, aux États-Unis, ont isolé et caractérisé ces gènes, dont les mutations étaient responsables de malformations décrites depuis le début du xxe siècle chez la mouche. Des homologues de ces gènes ont ensuite été trouvés chez d’autres lignées animales, telles que la souris et l’humain, ce qui prouvait que les mécanismes en jeu étaient très conservés dans le règne animal.
Par ailleurs, une découverte fondamentale a eu lieu : diverses équipes, notamment celle de Takashi Matsui, de l’université de Washington, à Saint-Louis (États-Unis), ont montré que, chez les eucaryotes aussi, des protéines jouent un rôle dans la régulation de l’expression des gènes. Nommées facteurs de transcription, elles interviennent notamment dans la différenciation cellulaire : ce sont elles qui guident la machinerie de transcription de l’ADN vers les gènes à traduire en protéines. Ainsi, pour chaque type cellulaire que l’on veut obtenir à partir de cellules souches, il existe un cocktail particulier de facteurs de transcription activant l’expression de gènes spécifiques de ce type cellulaire. Dans les années 1990-2000, des centaines de facteurs de transcription ont été identifiés, associés à chaque type de tissu : os, peau, cartilage, muscle… L’Institut Pasteur a participé à cette caractérisation. Notamment, dans les années 1990, Moshe Yaniv, Mary Weiss et leurs collègues ont mis en évidence de telles protéines régulant la différenciation des cellules du foie chez la souris.
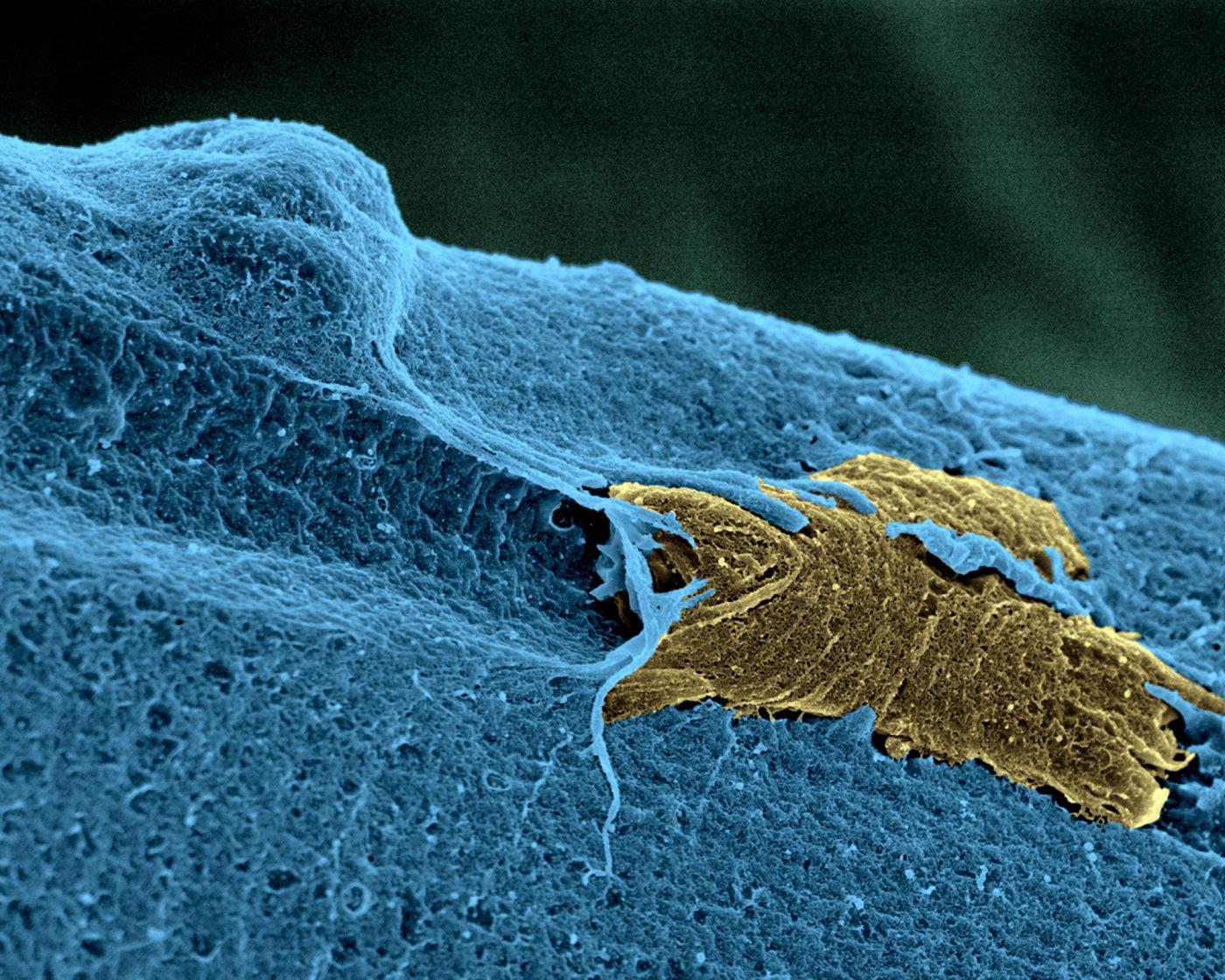
Cellule souche (en jaune) de muscle squelettique en état d’activation sur une fibre musculaire (en bleu). © Institut Pasteur/Unité d'Histopathologie humaine et modèles animaux - Plate-Forme Microscopie Ultrastructurale. Colorisation Jean-Marc Panaud.
Des cellules souches dans les muscles squelettiques
Shahragim Tajbakhsh et ses collègues ont mis en évidence une population de cellules souches musculaires plus quiescentes (dormantes) que les autres, et capables de revenir à un état actif en cas de blessure, signe qu’elles peuvent moduler leur métabolisme. En collaboration avec l’équipe de Fabrice Chrétien ces groupes ont montré, chez la souris et l’humain, que ces cellules sont capables de survivre plus de 2 semaines post-mortem et garder leurs potentiels régénérateurs.
Étudier les cellules souches pour elles-mêmes

Aujourd’hui, on sait différencier une cellule souche en n’importe quel type cellulaire, mais aussi faire revenir n’importe quelle cellule différenciée à un stade non différencié. La technique pour obtenir ces cellules souches pluripotentes « induites » (cellules iPS), beaucoup plus simple à mettre en œuvre que le transfert d’un noyau cellulaire dans un ovocyte (la technique utilisée pour cloner la brebis Dolly en 1997), a été mise au point par Shinya Yamanaka, de l’université de Kyoto, au Japon, en 2006, et récompensée par le prix Nobel en 2012. Les biologistes disposent aussi de dizaines de milliers de souris modifiées qui portent parfois plusieurs gènes mutés à plusieurs endroits, voire dont un gène a été supprimé. Il est aussi possible de produire des souris fluorescentes : on marque un gène d’intérêt avec un gène de méduse qui code une protéine fluorescente. Quand cette séquence est exprimée, elle produit une protéine portant une étiquette fluorescente qui permet de la suivre au microscope – lors de l’embryogenèse, par exemple, et dans l’organisme vivant.
Avec tous ces outils, les biologistes travaillent non seulement à préciser les mécanismes en jeu lors du développement embryonnaire, mais aussi à mieux caractériser les cellules souches elles-mêmes.
De façon générale, il faut s’assurer que les cellules pluripotentes soient éliminées, afin d’éviter la formation de tumeurs. Il s’agit aussi de préciser si les cellules souches pluripotentes induites, artificiellement produites, et les cellules souches embryonnaires ont les mêmes potentialités fonctionnelles. C’est une condition sine qua non pour les utiliser en thérapie cellulaire. Cela résoudrait aussi un problème éthique, les cellules souches embryonnaires étant issues d’embryons surnuméraires congelés après une fécondation in vitro réalisée dans le cadre d’un projet parental. Les cellules souches pluripotentes induites aideraient aussi à limiter les rejets, puisqu’il est possible de les produire à partir de tissus du patient lui-même.
Les enjeux de l’étude des cellules souches
Les enjeux sont multiples :
- comprendre le destin des cellules souches embryonnaires,
- comprendre la formation des tissus et des organes,
- explorer la biologie des cellules souches avec l’espoir de les utiliser en médecine régénérative contre des maladies telles que les maladies de Parkinson et d’Alzheimer, le diabète, certaines myopathies ou les maladies rétiniennes comme la DMLA (dégénérescence maculaire liée à l’âge) – toutes liées à la mort progressive de cellules.
Des essais cliniques sont ainsi en cours pour soigner des patients atteints de DMLA : on prend des cellules de peau des patients, on les reprogramme en cellules souches pluripotentes induites, puis on déclenche leur différenciation en précurseurs des cellules de la rétine, que l’on greffe dans l’œil du patient. Les premiers résultats sont prometteurs, mais il faudra encore du temps avant que cette technique ne soit utilisable de manière courante.
Les capacités des cellules souches
Le pouvoir d’utiliser différents modèles d’organismes permet d’exploiter les caractéristiques principales de chacun. Par exemple, le laboratoire de François Schweisguth a utilisé l’imagerie in vivo des précurseurs d’organes sensoriels de la mouche pour examiner comment les cellules acquièrent leur destin dans l’espace et le temps. Il ne s’agit pas d’un système typique de cellules souches où l’autorenouvellement est impliqué, mais plusieurs cycles de divisions cellulaires asymétriques se produisent pour générer un neurone et des cellules associées. Plusieurs facteurs clés, y compris Notch et Numb, sont impliqués dans la régulation de ces divisions asymétriques. Ces études fondamentales fournissent des informations critiques sur les divisions asymétriques, un mécanisme que les cellules souches déploient dans différents organismes pour générer des destinées cellulaires diverses, et pour s’autorenouveler.
L’équipe de Pablo Navarro Gil, de son côté, tente de mettre au jour le mécanisme qui permet aux cellules souches pluripotentes de le rester de génération en génération. En effet, les cellules souches embryonnaires s’autorenouvellent, c’est-à-dire qu’une partie d’entre elles donne naissance à de nouvelles cellules souches, constituant un réservoir cellulaire.
C’est d’ailleurs grâce à de tels réservoirs que certains animaux, tels la salamandre ou le lézard, ont la capacité, même à l’âge adulte, de régénérer leurs membres. Les mammifères, cependant, n’ont pas cette chance : ils se contentent de réparer leurs blessures. En effet, si le mammifère adulte compte toujours des cellules souches, elles perdent pour la plupart leur activité avec l’âge. Par exemple, les cellules souches hématopoïétiques, présentes dans la moelle osseuse, reconstituent en permanence les cellules sanguines, qui ontune durée de vie courte. Elles sont ainsi utilisées depuis plus de cinquante ans (greffées par injection intraveineuse, elles s’insèrent spontanément dans la moelle osseuse du receveur et s’y différencient correctement) pour lutter contre certaines maladies du sang et du système immunitaire. Les biologistes tentent donc de percer les secrets de ces cellules souches prénatale et postnatale : quel est leur potentiel respectif ? Comment le vieillissement agit-il sur elles ? Serait-il possible de les rajeunir ?
Ainsi, ces dernières années, l’équipe de Philippe Herbomel au sein du département pasteurien, a mis en évidence chez le poisson zèbre la niche où sont produites les cellules hématopoïétiques et, grâce à un traceur moléculaire, a suivi directement, in vivo, comment ces cellules émergent chez cet animal.
Bien que l’étude des cellules souches soit un thème majeur à l’Institut Pasteur, ce n’est pas une fin en soi, comme l’a montré déjà l’histoire des sujets de recherche du département aujourd’hui appelé Biologie du développement et cellules souches. En effet, une multitude de disciplines convergent pour aborder les principes fondamentaux de la régulation des gènes et l’identité cellulaire. Ceci inclut notamment l’épigénétique, l’épigénomique, la biophysique, l’analyse au niveau de cellules individuelles, et l’imagerie en direct pour comprendre comment les interactions entre cellules conduisent à la morphogenèse des organes dans le contexte de la croissance, de la régénération, des maladies ou encore du vieillissement. Aujourd’hui, la force de ce département demeure sa diversité, qu’il s’agisse des multiples organismes modèles (la mouche, le ver, le poisson zèbre, la souris ou les modèles aviaires), des technologies avancées, ou de l’étude des molécules, des cellules et des tissus. Récemment encore, cette diversité a été renforcée par le recrutement d’une nouvelle génération de leaders talentueux ayant une expertise dans tous ces domaines.
Ce ne sont que quelques-uns des thèmes de recherche explorés dans ce domaine à l’Institut Pasteur. François Jacob et Jacques Monod auraient-ils imaginé plus bel avenir pour leur département de biologie moléculaire ?
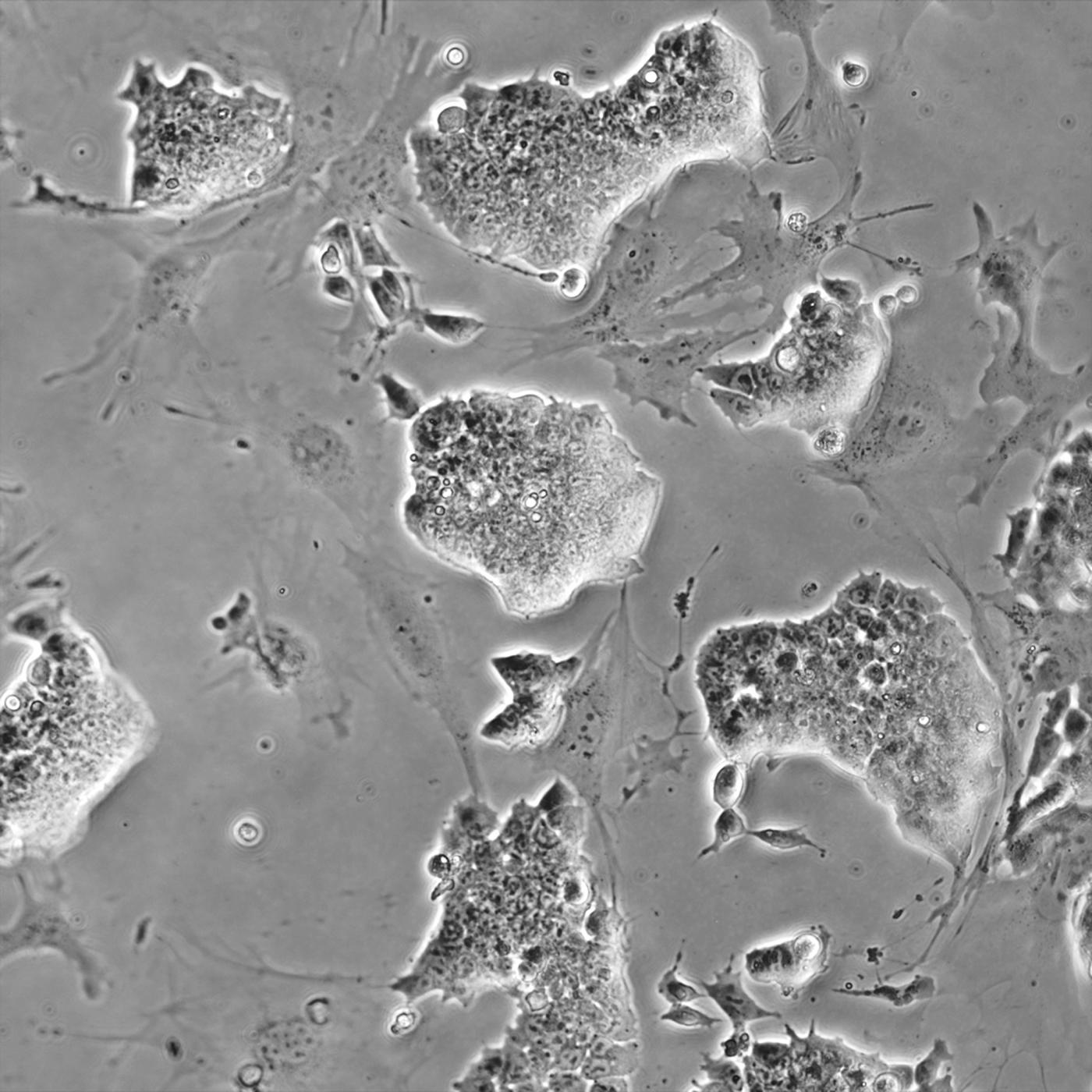
Colonies de cellules souches embryonnaires, avec des rares cellules isolées en différenciation spontanée. © Institut Pasteur/Alexandra Tachtsidi

L’Institut Pasteur remercie le collectif ayant réalisé l’ensemble de cet ouvrage.