Des chercheurs de l’Institut Pasteur et leurs partenaires du consortium international TBVAC 2020 viennent de mettre au point un candidat vaccin contre la tuberculose dérivé du BCG conventionnel. Celui-ci présente une efficacité accrue, grâce à l’ajout d’un système de sécrétion de protéines hétérologues, décuplant la qualité et l’importance de la réponse immunitaire contre les souches virulentes de Mycobacterium tuberculosis, la bactérie responsable de la maladie. Ces résultats encourageants ont été publiés dans Cell Reports du 14 mars 2017.
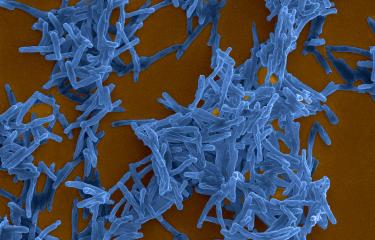
La tuberculose est une infection chronique causée par la bactérie Mycobacterium tuberculosis. Responsable de 1,8 millions de décès par an (chiffres OMS 2015), elle se classe toujours parmi les dix premières causes de mortalité dans le monde. Bien que très efficace chez l’enfant, le vaccin BCG, constitué d’une souche de Mycobacterium bovis atténuée, ne protège pas suffisamment les adultes, notamment contre la tuberculose pulmonaire, la forme la plus transmissible. La mise au point d’un vaccin qui protègerait mieux contre la maladie constitue donc un des objectifs prioritaires dans le contrôle de l’épidémie.
Depuis quelques années, des chercheurs de l’Institut Pasteur ont pu mettre en évidence des mécanismes qui caractérisent l’interaction de M. tuberculosis avec les cellules immunitaires de l’hôte. Lors de l’infection, la bactérie endommage, par l’intermédiaire d’un système de sécrétion spécialisé nommé ESX-1, la membrane de la vacuole de la cellule hôte dans laquelle elle est enfermée. La rupture de cette membrane provoque la mise en contact de la bactérie avec le milieu intérieur (cytosol) de la cellule. C’est ce signal qui déclenche alors dans la cellule une série de réponses immunitaires innées, visant à éliminer la bactérie. Or, à cause d’une délétion d’une région chromosomique, le BCG est dépourvu du système de sécrétion ESX-1. Son action protectrice ne repose donc pas sur cette puissante cascade de réactions immunitaires innées.
Les chercheurs de l’unité de Pathogénomique mycobactérienne intégrée de l’Institut Pasteur, dirigée par Roland Brosch, ont donc décidé d’exploiter cette nouvelle voie pour développer un candidat vaccin qui serait plus efficace que le BCG, en faisant l’hypothèse que la restauration de ces réponses immunitaires innées dans une souche vaccinale pourrait en améliorer le pouvoir immunogène. En exprimant le système de sécrétion ESX-1 de Mycobacterium marinum, une mycobactérie aquatique peu virulente, ils ont ainsi construit une souche recombinante de BCG capable d’induire le même type de réponse immunitaire que M. tuberculosis. « Le mécanisme clé est le contact établi entre les constituants de la bactérie et le cytosol, le milieu intérieur de la cellule hôte, alors que le BCG conventionnel reste prisonnier dans une vacuole et communique peu avec le cytosol de la cellule hôte », explique Roland Brosch. Les réponses immunitaires innées et adaptatives qui en résultent sont qualitativement et quantitativement améliorées et permettent une meilleure reconnaissance des antigènes mycobactériens. La souche obtenue reste d’une virulence atténuée, ce qui fait d’elle un bon candidat vaccin. Des souris vaccinées avec cette nouvelle souche ont été mieux protégées contre une infection ultérieure par M. tuberculosis que des souris vaccinées avec le BCG conventionnel.
Ces résultats, publiés dans le journal Cell Reports, ouvrent de nouvelles perspectives pour la mise au point d’un vaccin plus efficace contre les différentes pathologies provoquées par M. tuberculosis, notamment contre la tuberculose pulmonaire de l’adulte. Des expériences sont encore en cours avant un éventuel développement clinique incluant des essais chez l’homme. « Nous avons déposé un brevet sur cette souche avec la perspective de passer un jour à l’étape clinique », se félicite Roland Brosch.
Cette recherche a reçu le soutien financier de l’Union européen (consortium TBVAC2020), de la Fondation pour la Recherche Médicale (FRM) et le LabEx IBEID (laboratoire d’excellence Biologie Intégrative des maladies infectieuses émergentes) géré par l’Agence Nationale de la Recherche.
Source
Recombinant BCG Expressing ESX-1 of Mycobacterium marinum Combines Low Virulence with Cytosolic Immune Signaling and Improved TB Protection, Cell Reports, 14 mars 2017. http://dx.doi.org/10.1016/j.celrep.2017.02.057.
Matthias I. Gröschel (1,2), Fadel Sayes (1), Sung Jae Shin (3), Wafa Frigui (1), Alexandre Pawlik (1), Mickael Orgeur (1), Robin Canetti (1), Nadine Honore (1), Roxane Simeone (1), Tjip S. van der Werf (2), Wilbert Bitter (4, 5), Sang-Nae Cho (3), Laleh Majlessi (1) and Roland Brosch (1, 6)*
(1) Unit for Integrated Mycobacterial Pathogenomics, Institut Pasteur, 75015 Paris, France
(2) Department of Pulmonary Diseases & Tuberculosis, University Medical Center Groningen, University of Groningen, 9700 RB Groningen, the Netherlands
(3) Department of Microbiology, Institute for Immunology and Immunological Diseases, Brain Korea 21 PLUS Project for Medical Science, Yonsei University College of Medicine, 03722 Seoul, South Korea
(4) Department of Medical Microbiology and Infection Control, VU University Medical Center, 1081 HZ Amsterdam, the Netherlands
(5) Section Molecular Microbiology, Amsterdam Institute of Molecules, Medicine and Systems, Vrije Universiteit Amsterdam,1081 HZ Amsterdam, the Netherlands
(6) Lead Contact