Des chercheurs de l’Institut Pasteur, de l’université Paris-Descartes, du Centre hospitalier Sainte-Anne et du CNRS publient dans Nature Communications une étude dévoilant les atteintes musculaires sévères provoquées par le sepsis, ou septicémie, expliquant les lourdes séquelles des patients après la réanimation. Ils proposent une approche thérapeutique aux premiers résultats très encourageants, fondée sur la greffe de cellules souches mésenchymateuses, et permettant de restaurer, chez l’animal, les capacités musculaires.

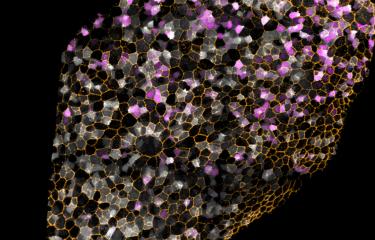
Tissu musculaire après sepsis. En rose, les fibres musculaires. Les espaces plus clairs entre les fibres correspondent aux défauts de régénération du muscle. © Institut Pasteur
Le sepsis, est une réponse inflammatoire généralisée de l’organisme, en réaction à une infection sévère. Mal connu du grand public, c’est une maladie très fréquente qui touche 28 millions de personnes dans le monde chaque année, et qui est responsable de 8 millions de décès. Si, grâce aux progrès de la médecine et notamment de la réanimation, la mortalité liée au sepsis diminue – en France, elle est néanmoins de 27%, et dans sa forme la plus grave, le choc septique, elle peut atteindre 50% - les patients qui survivent présentent de graves séquelles, notamment neurologiques et musculaires, qui les handicapent lourdement et les empêchent durablement de retrouver une vie active normale. Avec le vieillissement de la population, les projections suggèrent un doublement du nombre de cas de sepsis d’ici cinquante ans. Dans ce contexte, la recherche de pistes thérapeutiques constitue un enjeu majeur de santé publique.
Pour mieux comprendre la perte notable des capacités musculaires observée chez les patients, des chercheurs de l’unité d’Histopathologie humaine de l’Institut Pasteur, dirigée par le Pr Fabrice Chrétien[1], en collaboration avec le groupe de recherche mené au sein de l’unité Cellules souches et développement (Institut Pasteur/CNRS) par Miria Ricchetti, se sont intéressés aux conséquences du sepsis sur les cellules souches - dites cellules satellites - à l’origine des cellules des muscles des membres notamment. Ils ont observé chez la souris que ces cellules souches voyaient la masse de leurs mitochondries chuter drastiquement. Ces petits organites constituent les centrales énergétiques de la cellule : elles produisent l’ATP, la molécule-carburant nécessaire à toute réaction chimique. Les scientifiques ont ainsi montré qu’après un sepsis, les quelques mitochondries subsistant dans les cellules satellites leur permettaient tout juste de maintenir un fonctionnement minimal de survie, mais n’étaient pas suffisantes pour assurer leur division et leur différenciation en cellules musculaires en cas de besoin (croissance musculaire, réparation et maintenance). Cette atteinte, précoce et durable, empêche l’organisme de restaurer les fonctions musculaires et explique le déficit musculaire persistant observé chez les patients.
Ces travaux ont amené les chercheurs à envisager le recours à la greffe de cellules souches dites mésenchymateuses comme piste thérapeutique. Aisément cultivables en laboratoire, ces cellules sont connues pour leurs propriétés immunomodulatrices, ce qui en fait d’excellentes candidates à la greffe dans le cadre de thérapies cellulaires visant à réparer des lésions d’origine dégénérative ou traumatique. Fabrice Chrétien et son équipe ont ainsi pu montrer, sur un modèle murin, qu’une greffe de cellules souches mésenchymateuses effectuée après un choc septique directement au niveau intramusculaire permettait de diminuer le niveau d’inflammation globale et les symptômes associés : fièvre, atonie (absence de tonus), circulation des cytokines, les molécules inflammatoires etc. Grâce à une analyse histologique après la greffe, ils ont pu mettre en évidence que les cellules souches mésenchymateuses venaient supporter les cellules satellites en souffrance sans s’y substituer. Ensuite, elles étaient éliminées par l’organisme, alors que la greffe permettait de restaurer pleinement les dysfonctions mitochondriales et les capacités métaboliques et de division des cellules satellites.
Après ces résultats encourageants, les chercheurs espèrent maintenant pouvoir poursuivre leurs investigations chez l’Homme. La première phase des travaux, qui devrait permettre de vérifier si les mêmes atteintes tissulaires sont observées chez les patients, devrait pouvoir débuter prochainement.
[1] chef du service de Neuropathologie du Centre hospitalier Sainte Anne, Université Paris-Descartes
En savoir plus
Source
Sepsis induces long-term metabolic and mitochondrial muscle stem cell dysfunction amenable by mesenchymal stem cell therapy, Nature Communications, 15 décembre 2015.
P. Rocheteau †(1), L. Chatre †(2,3), D. Briand (1), M. Mebarki (1), G. Jouvion (1), J. Bardon (1), C. Crochemore (2,3), P. Serrani (1), P. P. Lecci (1), M. Latil (1), B. Matot (4,5), P. G. Carlier (4,5), N. Latronico (6), C. Huchet (7), A. Lafoux (7), T. Sharshar (1,8,9,10), M. Ricchetti (2,3) and F. Chrétien* (1,10,11,12)
† Ces auteurs ont contribué à part égale.
(1) Institut Pasteur Human Histopathology and Animal Models Unit, Infection and Epidemiology Department, Paris, France
(2) Institut Pasteur, Stem Cells and Development, Dept. of Developmental and Stem Cell Biology, Paris, France
(3) CNRS UMR 3525, Team Stability of Nuclear and Mitochondrial DNA
(4) Institute of Myology, NMR Laboratory, Paris France
(5) CEA, I2BM, MIRCen, NMR Laboratory, Paris, France
(6) Anesthesia and reanimation department, Department of surgery, University of Brescia, Italy
(7) INSERM UMR1087/ CNRS UMR6291, Institut du Thorax, Therassay, Université de Nantes, Faculté des Sciences et des Techniques, Nantes, F44322, France.
(8) Service de réanimation médico-chirurgicale adulte, Hôpital Raymond Poincaré, Garches, France
(9) Université Versailles Saint Quentin, France
(10) TRIGGERSEP, F-CRIN Network, France
(11) Laboratoire de Neuropathologie, Centre Hospitalier Sainte Anne, Paris, France
(12) Paris Descartes University, Sorbonne Paris Cité, Paris France