Maladie d’Alzheimer : vers de nouvelles pistes diagnostiques et thérapeutiques

Près d’un million de Français sont aujourd’hui atteints de la maladie d’Alzheimer. De nombreux espoirs ont été soulevés par la recherche dans le domaine des maladies neurodégénératives, qui sont au cœur des préoccupations du public. Mais le cerveau demeure encore et toujours un organe mystérieux, au fonctionnement complexe, encore largement méconnu. A l’Institut Pasteur, la connectivité cérébrale et les maladies neurodégénératives font partie des priorités scientifiques. La recherche fondamentale en neuroscience est indispensable pour espérer un jour offrir des pistes efficaces de traitement pour les maladies du cerveau.
Oublier son parapluie dans un magasin, égarer ses clés, cela arrive à tous et à tout âge ! Stress, fatigue ou simple problème d’inattention peuvent expliquer ces trous de mémoire. Avec l’âge, ces situations peuvent devenir plus fréquentes. Et d’aucun de craindre qu’une maladie d’Alzheimer s’installe. Pourtant, ce n’est que lorsque ces situations finissent par poser problème dans la vie quotidienne et/ou les relations sociales que l’on consulte son médecin traitant. Cette maladie est multifactorielle et évolutive. Et, si on compte 50 millions de personnes atteintes de démence dans le monde, dont 900 000 Français atteints de la maladie d’Alzheimer, elle reste encore compliquée à diagnostiquer.

La maladie d’Alzheimer, c’est quoi ?
La maladie d’Alzheimer est une maladie neurodégénérative d’évolution progressive (voir notre fiche maladie). Elle affecte principalement la mémoire, mais également d’autres fonctions cognitives, liées à la connaissance et mettant en jeu le langage, le raisonnement, l’apprentissage, etc. Cette maladie évolue généralement vers une perte d’autonomie de la personne qui en est atteinte. La maladie d’Alzheimer résulte d’une lente dégénérescence des neurones, débutant au niveau de l’hippocampe (une structure cérébrale essentielle pour la mémoire à court terme). Cette dégénérescence s’étend ensuite à d’autres régions cérébrales, puis à l’ensemble du cerveau.
Dans cette maladie, on observe l’accumulation dans le cerveau de deux types de protéines :
- Le peptide bêta-amyloïde, naturellement présent chez l’Homme, s’accumule sous une forme anormale chez les patients atteints de la maladie d’Alzheimer ; on parle de plaques dites amyloïdes (ou plaques séniles) qui sont toxiques pour les neurones.
- Les protéines tau, qui participent à l’architecture des neurones et à leur stabilité, s’accumulent de manière anormale. Ces processus d’agglutination empêchent un maintien des neurones entre eux.
L’hypothèse qui prévaut actuellement suppose que l’accumulation successive des plaques amyloïdes puis des protéines tau entraîne l’apparition des signes de la maladie. Les mécanismes du développement de la maladie d’Alzheimer restent encore largement inconnus à ce jour. La recherche fondamentale permet d’étudier les processus fondamentaux responsables des maladies, et est nécessaire pour développer des traitements efficaces.
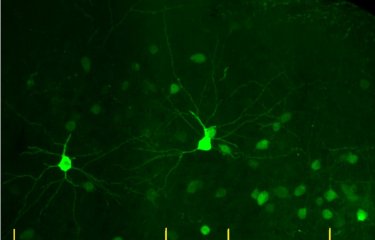
A l’Institut Pasteur, l’unité « Trafic membranaire et pathogenèse » dirigée par Chiara Zurzolo étudie les mécanismes du passage d’une cellule à l’autre des protéines amyloïdes. Les scientifiques ont découvert qu’il existe des connections directes entre les cellules neuronales qui permettent le passage des protéines amyloïdes. « Ces travaux ont pour le but de développer des outils qui permettraient de bloquer ce passage, et donc de retarder ou d’empêcher la progression de la maladie » explique Chiara Zurzolo.
L’Institut Pasteur s’engage pour mieux comprendre la connectivité cérébrale, notamment au bénéfice des maladies neurodégénératives
Alzheimer, Parkinson… les maladies neurodégénératives sont au cœur des préoccupations du public à une époque où de plus en plus de patients et de familles se retrouvent confrontées à ces nouveaux fléaux de santé publique. Depuis près de 20 ans, de nombreux espoirs ont été soulevés par la recherche scientifique dans ce vaste domaine mais ces premiers espoirs ont souvent été déçus, car le cerveau demeure encore et toujours un organe mystérieux, au fonctionnement complexe, encore largement méconnu.
La recherche fondamentale est donc indispensable pour espérer un jour offrir des pistes efficaces de traitement. Depuis les années 1960, l’Institut Pasteur compte de nombreuses équipes de recherche en neurosciences dont les découvertes ont acquis une reconnaissance internationale, depuis les travaux fondateurs du professeur Jean-Pierre Changeux jusqu’aux recherches du Dr David DiGregorio, directeur actuel du département de neuroscience de l’Institut Pasteur. L’Institut bénéficie d’expertises scientifiques très larges qui vont de l’étude des gènes jusqu’à l’observation du comportement des individus (de l’animal à l’Homme), en passant par l’étude des protéines, des synapses, des neurones, des réseaux de neurones, des régions du cerveau, dans des modèles animal et humaine. L’Institut Pasteur a acté l’importance de ce champ de recherche dans son plan stratégique 2019-2023. Il met ainsi à contribution toutes ses compétences pour appréhender la complexité des fonctions cérébrales.
Les projets de recherche « pasteuriens » portent sur les déficits sensoriels (surdité), sur les troubles neurodéveloppementaux (autisme) et psychiatriques (troubles de l’humeur et addictions), sur les maladies neurodégénératives (maladies d’Alzheimer et de Parkinson) et sur d’autres atteintes neurologiques comme le sepsis, ou encore les troubles neurovasculaires… L’expertise en biologie cellulaire et l'imagerie de pointe (microscopie en direct, microscopie électronique, super-résolution) permet d’étudier également la transmission des protéines malformées entre neurones et les mécanismes moléculaires de neurodégénérescence. Ces maladies dites de la connectivité cérébrale résultent d’altérations du réseau neuronal cérébral et des relations entre le cerveau et les autres organes. A l’Institut Pasteur, grâce aux multiples expertises issues de collaborations entre différents départements et disciplines (biologie cellulaire et développementale, immunologie, biologie computationnelle, plateforme technologique), il est possible d’avoir une vision globale de ces maladies. Cela permet d’intégrer le système nerveux central avec le système nerveux périphérique, le système immunitaire et l’environnement microbien.
L’importance d’un diagnostic précoce

Aujourd’hui, nous avons l’espoir de développer la même technique d’identification du développement précoce de la maladie d’Alzheimer pour l’appliquer à l’Homme en imageant les plaques et les dégénérescences neurofibrillaires par IRM.
Pierre LafayeResponsable de la plateforme Ingénierie des anticorps à l’Institut Pasteur
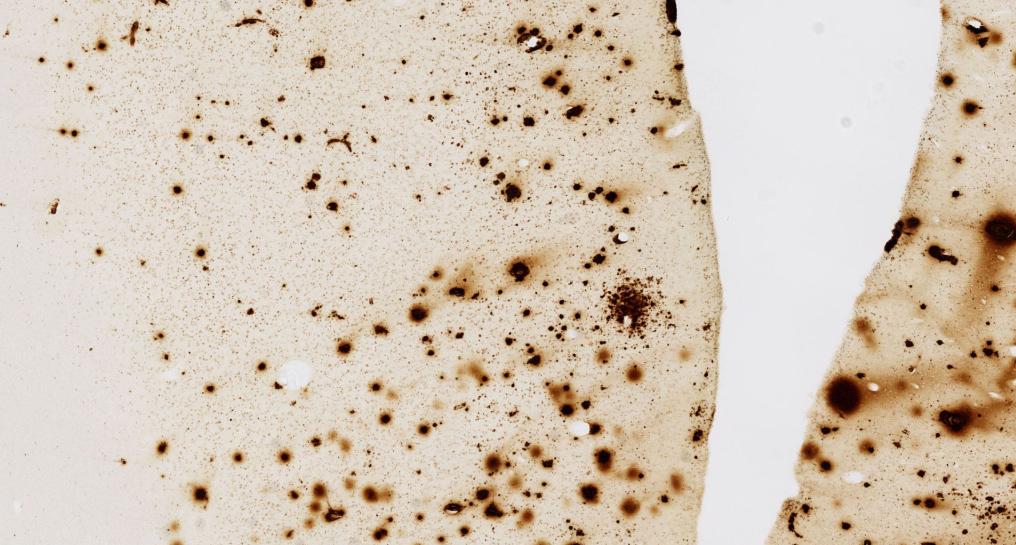
La maladie d’Alzheimer étant une maladie évolutive, il est très important de pouvoir la diagnostiquer à un stade précoce. La plateforme d’ingénierie des anticorps, dirigée par Pierre Lafaye à l’Institut Pasteur, a mis au point deux nouveaux types d’anticorps qui sont capables de détecter les cibles extracellulaires (les plaques amyloïdes) et intracellulaires) caractéristiques de la maladie d’Alzheimer.
Grâce à l’imagerie par fluorescence, les chercheurs ont ainsi développé une technique qui permettrait d’identifier au plus vite les personnes en train de développer la maladie d’Alzheimer présentant des symptômes non visibles cliniquement. Chez le modèle animal, les anticorps que les chercheurs ont développés se lient soit au peptide amyloïde soit aux dégénérescences fibrillaires. Seuls, ceux-ci ne sont pas visibles, mais une fois liés aux anticorps, on peut les localiser par imagerie par fluorescence. « Aujourd’hui, nous avons l’espoir de développer la même technique pour l’appliquer à l’Homme pour visualiser les plaques et les dégénérescences neurofibrillaires par IRM », explique Pierre Lafaye.
La génétique humaine également en cause
La recherche en génétique humaine a permis aussi des avancées importantes dans la compréhension de la maladie d’Alzheimer, ouvrant de nouvelles voies en termes de diagnostic et de suivi des patients. L’unité Neurobiologie intégrative des systèmes cholinergiques dirigée par Uwe Maskos, à l’Institut Pasteur, s’appuie de plus en plus sur la génétique humaine dans l’espoir de dépister rapidement la maladie.
Des altérations génétiques qui prédisposent à la maladie ont ainsi été identifiées. Les chercheurs travaillent sur un gène, spécifique de l’Homme, et qui, lorsque les personnes qui le portent ont perdu un ou deux allèles sur ce gène, seraient prédisposées à développer la maladie plus jeune et plus grave. Aujourd’hui, les chercheurs envisagent de proposer de nouveaux diagnostics précoces en étudiant la présence de ces altérations génétiques chez des personnes jeunes dont les apparentés sont touchés par la maladie d’Alzheimer et proposer une surveillance clinique accrue si tel est le cas. Ces personnes pourraient également être choisies préférentiellement lors des études cliniques. De premiers essais cliniques non concluants avaient déjà été menés sur une autre sous-partie du récepteur qui intéresse les chercheurs, le premier complètement bloqué par le peptide amyloïde.

L’importance de la recherche fondamentale est primordiale. C’est un outil essentiel qui donne aux chercheurs l’opportunité de comprendre la maladie avant d’imaginer des solutions pour la traiter. L’un des gènes de facteur de risque de la maladie d’Alzheimer est connu depuis 25 ans. Mais même si la piste est claire, nous n’avons pas encore compris les mécanismes qui relient ce gène à la maladie.
Uwe MaskosResponsable de l’unité Neurobiologie intégrative des systèmes cholinergiques à l’Institut Pasteur
Il s'agit d'un gène codant pour le récepteur nicotinique, cible de la nicotine dans le cerveau. On suppose que les sujets des essais cliniques étaient à un stade déjà trop avancé de la maladie, d’où la nécessité d’identifier et de dépister les patients à un âge plus jeune.
« L’importance de la recherche fondamentale est primordiale. L’un des gènes de facteur de risque de la maladie d’Alzheimer est connu depuis 25 ans. Mais même si la piste est claire, nous n’avons pas encore compris les mécanismes qui relient ce gène à la maladie ». Ce gène code pour une protéine appelée « lipoprotéine » et l’une des variantes de ce gène, appelée E4, donne une probabilité de 25% de développer la maladie.
Une autre mutation a été décrite chez 1 à 2% de la population dans le cadre de cas familiaux où la maladie peut se déclarer à 35 ans.
Le récepteur nicotinique de l’acétylcholine, une cible pour un futur traitement
L’unité dirigée par Uwe Maskos étudie également le rôle des récepteurs nicotiniques dans la maladie d'Alzheimer. Ces récepteurs sont une cible initiale du peptide amyloïde, et peuvent faire partie d'une approche thérapeutique nouvelle. Le laboratoire cherche à agir sur l’étape qui intervient juste après la première phase de la maladie, lorsque les traitements sont encore efficaces.
Les premiers neurones à dégénérer dans la maladie d’Alzheimer sont les neurones qui sont responsables de la libération de l’acétylcholine. D’après ces constats, plusieurs laboratoires pharmaceutiques ont développé des traitements qui permettent d’empêcher la dégradation de l’acétylcholine et en augmentent la concentration dans le cerveau. Ces traitements permettent, pendant quelques années, de stabiliser l'état du patient. « Si les traitements actuels permettent d’augmenter la concentration cérébrale en acétylcholine, elle n’est plus capable, à partir d’un certain moment, d’interagir correctement avec son récepteur nicotinique car le peptide amyloïde, en partie responsable de la maladie d’Alzheimer est de haute affinité avec ce même récepteur, et interfère avec cette interaction physiologique », explique Uwe Maskos. Car, si les dépôts insolubles du peptide forment les fameuses plaques amyloïdes, la partie soluble du peptide, invisible, interagit avec le récepteur. Depuis 2018, ces traitements ne sont plus remboursés en France.
L’impact de ce peptide a pu être mesuré chez un modèle animal grâce à une manipulation génétique. En observant différents comportements et en ciblant les conséquences du peptide amyloïde dans des petites structures du cerveau telles que l’hippocampe, qui est responsable de la formation de la mémoire, les chercheurs ont été capable de rendre visibles les conséquences de la maladie d’Alzheimer. En administrant un antagoniste de haute affinité avec le récepteur nicotinique, les chercheurs sont parvenus à protéger les modèles animaux de l’effet pathologique du peptide.
Les chercheurs s’appliquent donc aujourd’hui à développer un traitement grâce à un antagoniste qui serait capable de casser la liaison entre une sous-partie du récepteur nicotinique de l’acétylcholine et le peptide.
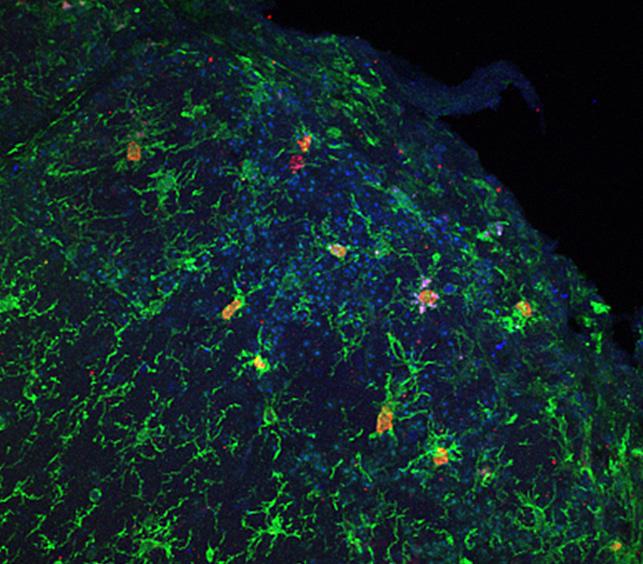
Le rôle inflammatoire des cellules micro-gliales
En observant des cellules non-neuronales du système immunitaire et leur rôle dans la maladie d’Alzheimer, les chercheurs ont identifié des cellules également impliquées dans la maladie : les cellules micro-gliales. Ces cellules font partie du système immunitaire du cerveau et agissent comme une « police ». Elles produisent notamment des substances qui aident au bon développement des synapses. Elles participent à la détection de l’accumulation du peptide amyloïde dans le cerveau. Dérivées des macrophages, elles sont capables « d’avaler » le peptide amyloïde en excès. Dans le cadre de la maladie d’Alzheimer, les chercheurs pensent que les cellules gliales finissent par être dépassées. « Nous cherchons à concentrer nos efforts sur une approche qui permettrait d’activer de manière plus importante ces cellules micro-gliales pour dégrader le peptide amyloïde et augmenter leur efficacité à tenir contre celui-ci dans un cerveau qui commence à être atteint par la maladie d’Alzheimer » explique Uwe Maskos.
Mais l’activation de ces cellules entraîne aussi la sécrétion de cytokines inflammatoires qui sont toxiques pour les neurones environnants. En effectuant leur travail de « police », elles provoquent en fait une neuro-inflammation. Un phénomène qui pourrait également concourir à la maladie d’Alzheimer. Un bon équilibre dans les approches thérapeutiques en cours est donc à trouver.
Vers la piste d'un traitement à la nicotine ?
Dans le cadre de la maladie de Parkinson et de la maladie d’Alzheimer, il est aujourd’hui clairement accepté par la communauté scientifique que l’effet de la nicotine est positif.
Chez les modèles animaux, l’administration d’une forte dose de nicotine seule permet la diminution des plaques amyloïdes. Il y a en effet des études biochimiques qui démontrent que la nicotine serait capable de "dissoudre" ces agrégats.
Aujourd’hui, les tests cliniques visent à apprécier la tolérance d’un tel traitement, par des patchs de nicotine, chez les personnes qui n’ont jamais consommé de tabac, par exemple.
Un diagnostic précoce et des traitements plus précis, sont les deux objectifs principaux que se fixent les chercheurs qui travaillent sur la maladie d’Alzheimer. Dans l’espoir qu’un jour la prise en charge des malades soit plus rapide et plus efficace.