Le paludisme et la mondialisation des maladies
Ce 18 mai 2022 est le centenaire du décès d’Alphonse Laveran, prix Nobel de médecine et découvreur du protozoaire responsable du paludisme (ou malaria) qui a causé des centaines de millions de morts à travers le monde depuis l’aube de l’humanité. Peu de maladies ont marqué l’histoire et la vie des hommes aussi durablement que le paludisme. Affection parasitaire évoluant de façon saisonnière plus que par poussées épidémiques, elle doit son autre nom, la malaria, à l’italien mala’aria qui signifie « mauvais air ». Ce terme traduit la croyance selon laquelle les eaux dormantes des marais ont le pouvoir de corrompre l’air et de le rendre insalubre.
Dans l’Antiquité, le parasite responsable du paludisme (le Plasmodium) sévissait dans le Bassin méditerranéen. Hippocrate décrit des fièvres évoluant par périodes de 3 ou 4 jours (fièvres tierces ou quartes), un rythme qui correspond au cycle du parasite dans l’organisme. À la chute de l’Empire romain, l’abandon des terres aux alentours de Rome, la Campagna Romana, aggrava l’infestation paludique et favorisa la colonisation de l’Europe du Nord par le Plasmodium, qui gagna ensuite le Nouveau Monde avec le commerce triangulaire.
Le paludisme a sans doute connu son apogée en Europe entre le XVIIe et le XIXe siècle, époque à laquelle Alphonse Laveran découvre le parasite (voir ci-dessous). À partir du XXe siècle, le recul de la maladie en Europe est lié à un ensemble de facteurs parmi lesquels l’assèchement des marais, la transformation des techniques agricoles et l’accroissement du niveau de vie. Avec 1 ou 2 degrés de plus, le réchauffement climatique pourrait cependant faire vaciller le fragile statu quo dont nous avons bénéficié depuis.
Un lourd fardeau sur le continent africain
En 2020, l’Organisation mondiale de la santé (OMS) estimait que plus de la moitié de la population mondiale était exposée au risque de contracter un paludisme. Cette année-là, on dénombrait 241 millions de malades, dont 627 000 en sont morts. L’infection est particulièrement grave chez les enfants de moins de 5 ans, les femmes enceintes, les malades immunodéprimés et, à un degré moindre, chez les personnes qui n’ont jamais été exposées et sont susceptibles de l’être : migrants non immunisés, populations itinérantes et voyageurs.
Si l’Asie du Sud-Est, l’Amérique latine et le Moyen-Orient sont touchés, c’est le continent africain qui paie le plus lourd tribut : 95 % des cas et 96 % des décès surviennent en Afrique subsaharienne. Des données plus récentes font cependant souffler un vent d’espoir. Depuis plusieurs années, un meilleur accès aux mesures préventives, au diagnostic et aux traitements curatifs a fini par porter ses fruits. Selon l’OMS, le taux de mortalité a baissé de 63 % entre 2000 et 2019, même si les dernières années ont été marquées par la fragilisation des systèmes de santé due à l’épidémie de Covid-19. La vigilance reste toutefois de mise au moment où les résistances des parasites aux antipaludéens et des moustiques aux insecticides s’accroissent et alors que des épidémies sont observées en dehors des zones d’endémie classiques, notamment en Afrique du Sud, au Costa Rica, au Venezuela et en Malaisie.
En France, le nombre de cas d’importation a été estimé à 2895 en 2019. 10 décès a été déclaré, soit une létalité de 0,35% sur l’ensemble des cas et de 2,5 % sur les formes graves...

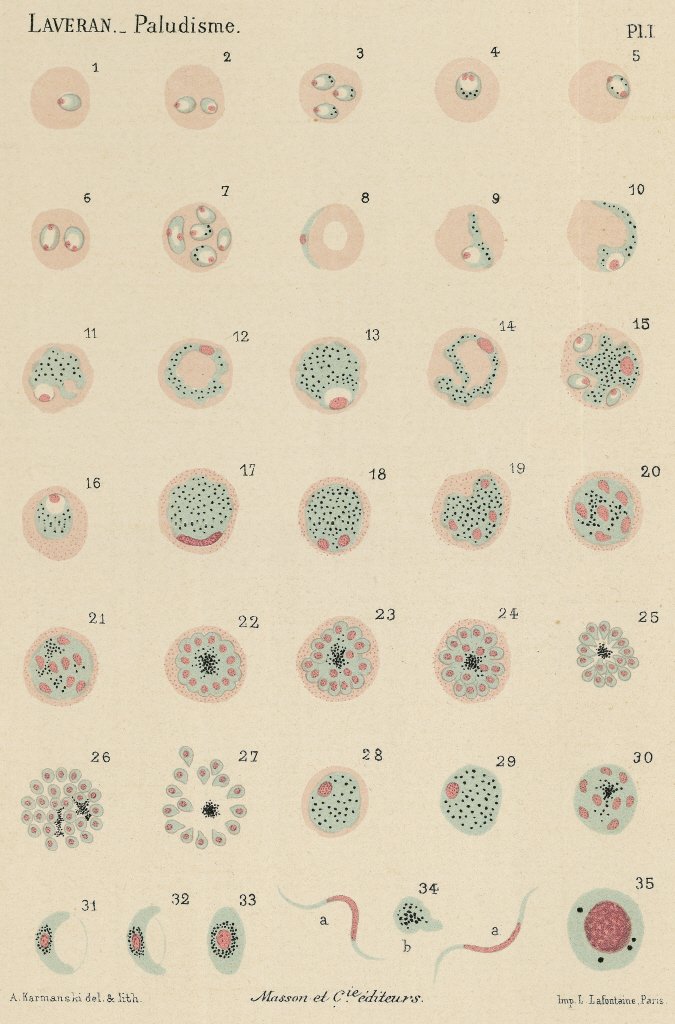 Travaux d’Alphonse Laveran sur l’hématozoaire, agent du paludisme. Différents aspects dans le sang frais. Planche aquarellée, 1880. |
Une maladie potentiellement mortelle
Le paludisme est dû à un parasite du genre Plasmodium. La maladie se manifeste par la survenue brutale d’une forte fièvre, 8 à 30 jours après la piqûre infectante. Celle-ci peut s’accompagner de frissons annonciateurs (prodromes), de maux de tête, d’un affaiblissement général, de douleurs musculaires, de troubles digestifs (vomissements, diarrhée) et de toux. Des crises (ou accès palustres), avec fièvre, tremblements, sueurs froides et transpiration, alternent avec des moments d’accalmie. Cette périodicité correspond au cycle du Plasmodium, les accès coïncidant avec la multiplication du parasite et l’éclatement des globules rouges.
Le parasite, le moustique et l’homme : une relation triangulaire
Le paludisme est une maladie à transmission vectorielle, ce qui signifie que l’agent pathogène infecte l’homme (ou l’animal) par l’intermédiaire d’un organisme vivant qui l’héberge transitoirement, le plus souvent un insecte hématophage. Le Plasmodium est transmis par les piqûres des anophèles femelles, des moustiques dont on connaît plus de 400 espèces, une trentaine d’entre elles étant susceptibles de transmettre ce parasite. Ces moustiques ont besoin de sang pour se reproduire et nourrir leurs œufs, qui sont ensuite pondus dans l’eau où ils éclosent en larves avant de devenir adultes. La femelle s’infecte en piquant un sujet impaludé, la contamination d’homme à homme se faisant par l’intermédiaire du moustique. La transmission est inter- humaine lorsque le parasite passe de la mère à l’enfant en franchissant la barrière placentaire ou lors d’une transfusion sanguine de sang infecté.
Le cycle du Plasmodium est complexe. Les parasites se multiplient par simple division cellulaire (phase asexuée) dans le foie et dans les globules rouges de l’hôte humain. Une métamorphose s’opère ensuite pour un certain nombre d’entre eux et des parasites sexués, mâles et femelles, se forment. Quand l’anophèle femelle pique un sujet infecté, elle aspire des gamétocytes1 qui se reproduisent dans son estomac, puis gagnent ses glandes salivaires. Le moustique peut alors contaminer un homme par piqûre, et perpétuer ainsi le cycle du Plasmodium.
 Révélation par immunofluorescence de la présence de la protéine Pf155/RESA dans les globules rouges infectés par Plasmodium falciparum. |
1 Cellules répandues dans le sang des paludéens, à partir de laquelle se forme le gamète (cellule reproductrice) du parasite du paludisme.
On distingue cinq espèces de parasites infectant l’homme Plasmodium falciparum est responsable des formes les plus fréquentes et les plus sévères de paludisme. Espèce dominante en Afrique, il se rencontre également dans les zones tropicales d’Amérique latine et d’Asie. Sans traitement dans les 24 heures, la maladie qu’il provoque peut être mortelle, du fait notamment d’une anémie profonde avec un effondrement du taux d’hémoglobine. Les globules rouges parasités peuvent aussi adhérer entre eux et à la paroi des petits vaisseaux sanguins irriguant le cerveau, et provoquer un neuropaludisme de sombre pronostic.
Moins pernicieux, P. vivax cohabite dans la plupart des régions où sévit P. falciparum et prédomine en Amérique du Sud. Plus rares, les deux autres espèces ont la propriété d’entraîner des rechutes tardives : P. ovale, présent en Afrique de l’Ouest, peut être à l’origine d’accès quatre à cinq ans après les premiers symptômes, et P. malariae, réparti de façon très inégale dans le monde, peut se manifester jusqu’à vingt ans après un épisode inaugural. Enfin, des cas humains d’infection par P. knowlesi, qui infecte habituellement le singe, sont régulièrement rapportés.
Prévention et traitement : l’escalade des résistances
Deux types de traitement sont à distinguer : le traitement préventif qui vise à éviter l’infection, et le traitement curatif dont le but est de traiter l’accès palustre. Bien que les médecins disposent de plusieurs médicaments utilisables dans un cas comme dans l’autre, ces traitements se heurtent à une résistance croissante du parasite.

L’Institut Pasteur est fortement engagé depuis plusieurs décennies dans la surveillance du niveau de résistances des parasites du paludisme aux antipaludiques. Elle mène dans les zones d’endémie palustre des études cliniques, épidémiologiques et génomiques pour évaluer l’adéquation entre les recommandations en matière de traitement et le niveau de sensibilité des parasites.
Didier MénardResponsable de l’unité Génétique du paludisme et résistance à l’Institut Pasteur de Paris.
Le traitement préventif
Le premier traitement préventif ne fait pas uniquement appel à des médicaments mais également aux moyens susceptibles d’éviter les piqûres d’anophèles. Le recours massif à ces mesures antivectorielles a fait reculer l’incidence du paludisme ces dernières années dans des zones de fortes endémies. L’OMS et les autorités sanitaires locales conseillent deux formes d’actions particulièrement efficaces : l’utilisation de moustiquaires imprégnées d’insecticides et la pulvérisation d’insecticides à effet rémanent à l’intérieur des habitations. Pour les voyageurs, l’utilisation de moustiquaires mais aussi le port de vêtements longs et imprégnés, et l’application de produits répulsifs sur les parties découvertes diminuent le risque d’être piqué.
Un traitement préventif est impératif en cas de déplacement dans une zone d’endémie palustre, notamment pour les femmes enceintes et les enfants chez lesquels le risque d’accès graves est accru. La prescription de cette chimioprophylaxie nécessite une consultation médicale, car sa nature et sa durée dépendent de plusieurs facteurs : la destination, les caractéristiques individuelles (âge, antécédents médicaux, intolérance à des médicaments, etc.) et la durée du déplacement. Outre les conseils généraux accessibles en ligne, les experts du Centre médical de l’Institut Pasteur proposent des consultations spécialisées afin de recommander les mesures adaptées à chacun et à chaque situation. Quatre médicaments principaux sont utilisés. Leur choix est notamment conditionné par l’existence de résistance dans la zone de déplacement : la chloroquine (dans les zones encore sensibles, de plus en plus rares), le médicament associant atovaquone et proguanil, la méfloquine (qui pose des problèmes de tolérance) et la doxycycline.
La chimioprophylaxie n’est pas uniquement réservée aux voyageurs puisque, depuis 2012, l’OMS recommande une prévention médicamenteuse saisonnière en Afrique subsaharienne pour les femmes enceintes et les enfants de moins de 5 ans.
 Le Centre de Production et d’Infection des Anophèles (CEPIA) est une plate-forme dédiée à la production en masse de moustiques du genre Anopheles pour la recherche. Le CEPIA permet l’étude des interactions entre Plasmodium, parasite responsable du paludisme, et leurs hôtes mammifère ou moustique. |
Le traitement curatif
Le traitement débute après confirmation du diagnostic, qui consiste traditionnellement à rechercher des plasmodies (parasites du genre Plasmodium) par examen d’un prélèvement sanguin au microscope. Des diagnostics rapides se sont répandus depuis une vingtaine d’année, qui permettent d’obtenir une réponse en moins de 30 minutes en recueillant une simple goutte de sang sur le bout du doigt. Les équipes du Pasteur Network évaluent régulièrement les performances de ces tests de diagnostic rapide.
La résistance du Plasmodium aux traitements classiques, comme la chloroquine et l’association sulfadoxine-pyriméthamine, s’est généralisée dans les années 1950-1960. L’apparition des résistances a conduit l’OMS à recommander, dès 2001, en Asie du Sud puis en Afrique, le recours à une combinaison de traitements à base d’artémisinine : les ACT (Artemisinin-based Combination Therapy). L’artémisinine est extraite d’une plante connue depuis plus 2 000 ans en Chine pour ses vertus médicinales. Cette recommandation a toujours cours car les ACT se révèlent efficaces malgré l’émergence de la résistance à l’artémisinine.
Impliqués dans un projet, soutenu par l’OMS, de surveillance moléculaire de la résistance en Afrique, des chercheurs de l’Institut Pasteur ont récemment identifié en Afrique les premiers signes d'émergence de parasites mutants K13 résistants à l’artémisinine. Ces résultats décrivent la présence en proportions significatives de parasites porteurs de la mutation R561H, dans deux localités distantes de 100 km (prévalence de 7,4% à Masaka et de 0,7% à Rukara). Le séquençage complet de ces parasites indique que les mutants R561H ont été sélectionnés parmi les populations de parasites Rwandaises et qu’ils ne sont pas issus d’une diffusion de parasites asiatiques (de Thaïlande ou du Myanmar où la mutation R561H a déjà été observée). « Ces résultats inattendus, contrastent avec les scénarios précédents dans lesquels l’émergence de parasites résistants à la chloroquine et à la pyriméthamine en Afrique était due à la propagation de parasites résistants d’Asie du Sud-Est. Un scénario similaire était envisagé pour l’apparition de parasites résistants à l’artémisinine en Afrique » explique Didier Ménard, responsable de l’unité Génétique et résistance du paludisme à l’Institut Pasteur (Paris). La mise en évidence d’une diffusion de cette souche résistante entre plusieurs localités au Rwanda et sa capacité de résister in vitro à l’artémisinine ont des implications majeures en santé publique. Il est en effet à craindre, qu’en l'absence de mesures efficaces pour contenir la propagation de ces parasites résistants au Rwanda et dans les pays voisins, ces parasites acquièrent au cours du temps la capacité de résister aux molécules partenaires contenues dans les ACT. Il en résulterait que les seuls traitements disponibles deviendraient inefficaces, comme cela s’est produit en Asie du Sud-Est. Une modélisation de ce scenario, dans lequel aucune mesure ne serait prise, a récemment prédit que l’inefficacité des ACT en Afrique pourrait être responsable de 78 millions de cas et de 116 000 décès supplémentaires sur une période de cinq ans.
Épidémiologie des résistances
L’expansion de la résistance du parasite aux traitements disponibles pose un problème de santé publique majeur. Elle nécessite d’abord une évaluation régulière de la sensibilité du Plasmodium et de son évolution dans les différentes régions du monde. L’OMS s’est impliquée dans cette mission à laquelle le Pasteur Network participe activement, en particulier les membres des pays à endémie palustre, comme le Cambodge, Madagascar, le Sénégal, la Côte d’Ivoire, le Niger et en République centrafricaine. Pour sa part, l’Institut Pasteur de la Guyane est Centre national de référence de la chimiorésistance du paludisme pour la région Antilles-Guyane. L’équipe dirigée par Lise Musset étudie les parasites et leurs résistances en testant la sensibilité des échantillons collectés à huit molécules utilisées en thérapeutique et en recherchant les gènes de résistance. Elle a montré qu’une mutation du gène pvmdr1 permet aux souches de Plasmodium vivax circulant en Guyane de résister à la chloroquine.
 Mise en place d’un piège à moustiques dans la commune de Matoury, dans le cadre d’études sur la transmission du paludisme (mission entomologique à Maripasoula, Guyane, mars 2016). |
Les obstacles à la vaccination
Il existe depuis 2016 un premier vaccin contre le paludisme, le RTS,S/ ASO1, qui a reçu un avis favorable de l’Agence européenne du médicament et a été autorisé par l’OMS pour une utilisation chez les enfants sur le continent africain. Son efficacité est toutefois limitée et les quatre injections requises ne permettent pas d’installer une immunité durable. Le 6 octobre 2021, L’OMS a recommandé l’utilisation du vaccin RTS,S en prévention du paludisme à P. falciparum chez les enfants vivant en zone de moyenne ou forte transmission.
La principale difficulté du vaccin contre le Plasmodium tient au fait que le parasite échappe au système immunitaire. Un premier accès n’entraîne ni production d’anticorps, ni mémoire de l’infection. Seules les personnes chroniquement impaludées bénéficient d’un certain degré de protection. Pour mettre au point ce vaccin, les chercheurs ont fusionné un antigène du parasite à celui de l’hépatite B, ce dernier étant chargé de provoquer la réponse immunitaire.
À l’Institut Pasteur, Salaheddine Mécheri a développé au sein de l’unité de Biologie des interactions hôte-parasites, dirigée par Artur Scherf, une approche vaccinale originale contre le paludisme. Des travaux antérieurs de ce groupe ont démontré que la production précoce de la cytokine IL-6 (une protéine impliqué dans l’immunité) dans le foie de l’hôte conduit à l'acquisition d'une protection immunitaire de longue durée. Chez la souris, les chercheurs ont exploré une approche où est inoculé un parasite qui code lui-même pour le gène murin de l'IL-6. L'immunisation de souris avec des parasites transgéniques a suscité une immunité protectrice de longue durée contre une provocation ultérieure par des parasites infectieux. Cette étude démontre que l'IL-6 codée par le parasite transgénique altère l'infection par le parasite Plasmodium classique qui reste bloqué au stade hépatique, constituant ainsi une nouvelle stratégie vaccinale pour susciter une immunité antipaludique protectrice. Ce nouvel outil vaccinal est en train d’être étendu au parasite Plasmodium falciparum, la souche infectant l’homme.
Chetan Chitnis, responsable de l’unité Biologie de Plasmodium et vaccins, développe un vaccin contre Plasmodium vivax, la seconde espèce de Plasmodium responsable d’une morbidité importante. P. vivax a une caractéristique unique : il dépend d’une liaison à l’antigène Duffy, situé sur les globules rouges humains, pour les infecter. L’équipe de Chetan Chitnis a identifié le domaine de liaison sur la protéine Duffy du parasite (PvDBP), et développe un vaccin basé sur ce domaine fonctionnel. Les anticorps ciblant PvDBP bloquent l’interaction de P. vivax avec les globules rouges et peuvent prévenir l’infection au stade sanguin. Un vaccin basé sur cette stratégie est actuellement testé dans des essais cliniques de phase précoce en collaboration avec le Jenner Institute de l’Université d’Oxford et le Centre international de génie génétique et de biotechnologie (ICGEB) de New Delhi.
L’unité Infection et immunité paludéenne a quant à elle étudié les sporozoïtes, ces cellules du parasite du paludisme qui infectent de nouveaux hôtes, en quittant le moustique et en pénétrant dans le foie, où elles se multiplient. L’équipe a récemment découvert comment les anticorps cytotoxiques dirigés contre la principale protéine de surface des sporozoïtes (CSP), qui est la base antigénique du premier vaccin contre le paludisme, peuvent bloquer efficacement l’infection dans les tissus de l’hôte. En identifiant des antigènes protecteurs et en les combinant avec la CSP, un vaccin multi-antigénique a été développé avec une efficacité hautement protectrice dans un modèle préclinique.
L’entomologie pour lutter contre les maladies à transmission vectorielle
Plus de 3 millions d’espèces d’insectes sont recensées à ce jour, c’est dire l’immensité de la tâche des entomologistes, les scientifiques qui s’intéressent à ces êtres vivants. Un certain nombre d’espèces sont susceptibles de transmettre des agents infectieux à l’homme et sont vecteurs de maladies. Il s’agit d’insectes qui piquent, souvent friands de repas sanguins. Dans cet inquiétant bestiaire, on trouve pêle-mêle : des tiques (maladie de Lyme), des mouches (maladie du sommeil ou trypanosomiase pour la mouche tsé-tsé), des moucherons (onchocercose), des puces (peste), des punaises (maladies de Chagas) et, bien sûr, des moustiques vecteurs de pathologies infectieuses et parasitaires dont le paludisme, le chikungunya, la dengue, Zika, mais aussi la fièvre de la vallée du Rift, la fièvre jaune, la fièvre du Nil occidental, l’encéphalite japonaise ou la filariose lymphatique. Capables de transmettre plus d’une centaine de maladies, les moustiques sont l’ennemi public n° 1.
Comprendre leur physiologie et leurs capacités d’adaptation est un objectif prioritaire dans la lutte contre les maladies à transmission vectorielle, sur- tout pour les moustiques qui transmettent le virus de la dengue, de Zika ou encore du chikungunya (dits arbovirus). À l’Institut Pasteur à Paris, l’unité Arbovirus et insectes vecteurs dirigée par Anna-Bella Failloux étudie les interactions entre le moustique, le virus et l’environnement. Elle identifie les facteurs favorisant l’émergence de pathogènes responsables d’épidémies humaines, facteurs liés à l’interaction entre l’arbovirus et son vecteur, mais aussi aux changements environnementaux et/ou climatiques qui affectent l’organisation des populations de moustiques. L’unité dispose d’une infrastructure pour élever les moustiques, qui abrite les espèces les plus délétères pour l’homme, et d’un laboratoire de niveau P3 permettant de réaliser des infections expérimentales sur des modèles animaux. Anna-Bella Failloux et son équipe collaborent de façon privilégiée avec les instituts membres du Pasteur Network.
 Stade mérozoïte de Plasmodium falciparum, forme infectieuse qui va envahir le globule rouge. |
L’Institut Pasteur de la Guyane a lancé une vaste enquête épidémiologique (EPI-ARBO) auprès de la population pour évaluer précisément l’impact des arbovirus dans ce pays. Il dispose depuis 2014 d’une plateforme d’étude des insectes vecteurs : le vectopôle amazonien Émile-Abonnenc, du nom du premier entomologiste de l’Institut guyanais. Dans cet insectarium, les entomologistes classent les moustiques qui, avec un cycle d’environ 700 générations par an, évoluent de façon continue en produisant de nouvelles espèces. Pas moins de 250 d’entre elles, sur les plus de 3 500 connues dans le monde, ont pour l’heure été recensées dans cette région d’Amérique du Sud. Un laboratoire surveille l’évolution de la résistance des arthropodes aux insecticides. Enfin, comme à Paris, un laboratoire de niveau P3 réalise des contaminations expérimentales. Au Cambodge, une plateforme d’entomologie médicale dirigée par Sébastien Boyer et supervisée par Didier Fontenille, directeur de l’Institut Pasteur local, existe depuis 2015. En plus du paludisme, de la dengue, de Zika et du chikungunya, l’encéphalite japonaise fait l’objet d’études approfondies. D’autres instituts, comme celui de Bangui ou de Dakar, participent activement à la surveillance des moustiques vecteurs d’arboviroses, en formant un réseau international sans pareil.
 Globule rouge parasité par Plasmodium falciparum |
Les anémies héréditaires, principalement drépanocytose et thalassémie, sont des maladies de l’hémoglobine d’origine génétique. Dès les années 1920, des médecins se sont interrogés sur une possible relation entre ces maladies et le paludisme. D’une part, ils avaient remarqué que la répartition géographique de ces pathologies était superposable, tant en Afrique subsaharienne que dans le Bassin méditerranéen. D’autre part, il fallait expliquer pourquoi les gènes de ces maladies, délétères, étaient si répandus. Enfin, des spécialistes italiens avaient relevé qu’en Sardaigne, alors région de forte endémie palustre, la thalassémie était courante dans les zones côtières et pratiquement absente dans les montagnes. Un généticien des populations, John B. S. Haldane, avança la solution de cette énigme : les porteurs d’une seule copie préjudiciable du gène (hétérozygotes) sont plus résistants au paludisme que ceux ayant une hémoglobine normale. Chez les hétérozygotes, la thalassémie représente un avantage sélectif dans les zones d’endémie palustre, les globules rouges défectueux entravant le cycle du parasite.
L’anémie d’origine génétique est en revanche rare dans les zones où le paludisme est absent, comme en montagne où le moustique disparaît à partir d’une certaine altitude. Cette hypothèse fut confirmée par Anthony C. Allison en 1954 : il montra que les taux de plasmodies dans le sang étaient plus bas chez des habitants des rives du lac Victoria hétérozygotes pour la drépanocytose.
Ainsi, une maladie génétique héréditaire peut interférer avec une maladie parasitaire à transmission vectorielle, elle-même à l’origine d’une sélection des populations humaines.