L’unité de Ludovic Deriano a étudié des cellules mutées pour le NHEJ, la voie de réparation des cassures double brin de l’ADN canonique. Les chercheurs ont montré que ces cellules transformées dépendaient d’autres activités de réparation (NHEJ alternatif) pour survivre aux dommages induits sur l’ADN, dans des conditions G1 non cycliques (voyant la cellule cesser de croître et de se diviser). Cette voie de réparation alternative représente une cible intéressante pour les futures thérapies anticancéreuses reposant sur la réparation de l’ADN.
Les cellules cancéreuses présentent fréquemment des mutations somatiques altérant la réparation de l’ADN, ce qui provoque une instabilité génomique et favorise l’apparition de tumeurs et leur évolution. Le concept de létalité synthétique décrit des configurations dans lesquelles une mutation viable pour la cellule devient mortelle si elle est associée à une autre mutation spécifique. Il peut être exploité en présence d’une malignité car les cellules tumorales, contrairement aux cellules saines des tissus normaux, s’appuient sur d’autres activités de jonction d’extrémités compensatrices pour survivre au stress génotoxique endogène ou lié au traitement du cancer. Dans le cadre de ses travaux, l’unité Intégrité du génome, immunité et cancer (Ludovic Deriano) a étudié des cellules transformées, mutées pour la voie de réparation des cassures double brin de l’ADN canonique appelée NHEJ (jonction d’extrémités non homologues) intervenant généralement en phase G1, la première des quatre phases du cycle cellulaire. Elle montre que ces cellules transformées reposent sur des activités de réparation alternatives pour survivre aux dommages induits sur l’ADN, dans des conditions G1 non cycliques (voyant la cellule cesser de croître et de se diviser). Le choix des voies de réparation des cassures double brin de l’ADN dépend des phases du cycle cellulaire (G1, S, G2...).
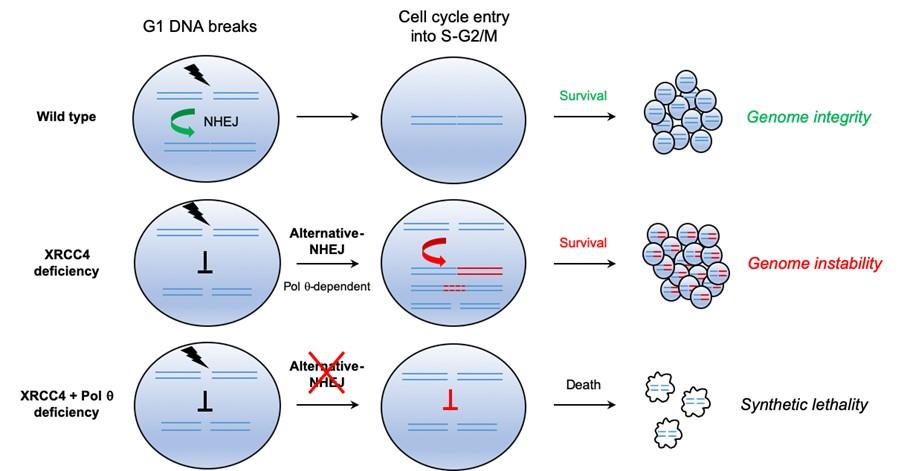
Une fois que les cellules endommagées reprennent la prolifération cellulaire, la réparation alternative médiée par l’ADN polymérase thêta (Polθ) provoque une instabilité génétique prenant la forme de grandes délétions génomiques et de translocations chromosomiques. L’étude révèle également qu’en inhibant le NHEJ alternatif, il est possible d’exploiter la vulnérabilité des cellules aux lésions de l’ADN à G1 aux fins du traitement de certains cancers.
Source: Nat Commun. 2020 Oct 16. doi: 10.1038/s41467-020-19060-w
Cette étude entre dans le cadre de l’initiative Cancer du plan stratégique 2019-2023 de l’Institut Pasteur.