Des chercheurs de l’Institut Pasteur et du CNRS, en collaboration avec l’Imperial College (Londres) ont identifié un site vulnérable à la surface du virus de la dengue, qui est ciblé par les seuls anticorps neutralisants à spectre large identifiés jusqu’à présent. Cela en fait une nouvelle cible pour le développement d’un vaccin, qui serait alors efficace contre les quatre types de virus de la dengue qui circulent aujourd’hui. Ces résultats ont été publiés dans la revue Nature, le 12 janvier 2015.
Communiqué de presse
Paris, le 14 janvier 2015

La dengue, transmise par des moustiques, est la maladie virale la plus largement répandue dans les régions tropicales de la planète. Deux milliards et demi de personnes vivent dans des zones à risque. Il existe quatre virus de dengue différents, dénommés par les sérotypes DEN-1, DEN-2, DEN-3 et DEN-4. Les anticorps spécifiques d’un sérotype, produits chez un patient lors d’une première infection ne confèrent pas de protection efficace contre une nouvelle infection par les autres sérotypes. Ces anticorps spécifiques peuvent même constituer un facteur de risque de développer alors une dengue hémorragique. Le développement d’un vaccin contre la dengue requiert donc de protéger simultanément et efficacement contre les quatre sérotypes du virus.
Dans un article publié dans Nature, co-signé par des équipes de l’Institut Pasteur, du CNRS et de l’Imperial College, des chercheurs montrent l’existence d’une région de la protéine d'enveloppe du virus, exposée aux anticorps, qui est commune aux quatre sérotypes de la dengue. Cette région représenterait donc une cible intéressante pour le développement d’un vaccin efficace contre les quatre sérotypes de la dengue.
Pour obtenir ces résultats, les scientifiques ont collaboré avec une équipe de l’Imperial College, qui était précédemment parvenue à identifier et à isoler, à partir d’une cohorte de patients infectés en Thaïlande, des anticorps neutralisant simultanément les quatre sérotypes du virus. Pour autant, le mode d’action de ces anticorps demeurait alors incompris.
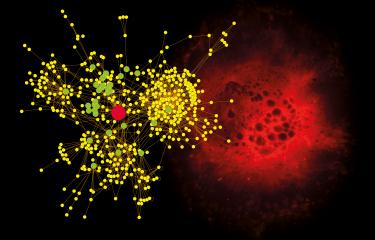
Grâce à un travail cristallographique, utilisant le rayonnement des synchrotrons SOLEIL (Saint-Aubin, Essonne) et ESRF (Grenoble), les scientifiques ont étudié la protéine d’enveloppe du virus de la dengue en complexe avec ces anticorps particuliers. Ils ont ainsi pu déterminer la structure 3D de ce complexe. Leurs analyses ont ainsi permis d’identifier le site de fixation des anticorps sur la protéine d’enveloppe. Commun aux quatre sérotypes du virus, ce site apparait alors comme une région d’intérêt vaccinal évident.
Ce site de fixation des anticorps sur la protéine d’enveloppe s’est également révélé être celui d’une autre protéine du virus, prM. L’interaction entre la protéine d’enveloppe et cette protéine prM est essentielle à la production de particules virales infectieuses lors de la réplication du virus dans les cellules infectées.
Ces observations ont permis aux chercheurs de comprendre la raison pour laquelle ce site de fixation commun, malgré la faille qu’il représente pour le virus, soit très conservé chez tous les sérotypes : une légère mutation sur ce site permettrait en effet au virus d’échapper au système immunitaire, mais par la même occasion, l’empêcherait d’établir l’interaction avec prM, essentielle à sa réplication.
L’analyse des structures cristallographiques révèlent ainsi un "talon d'Achille" du virus, que les scientifiques pourront désormais exploiter en proposant la conception d'un déterminant antigénique unique mimant le site de fixation. Capable de déclencher une réponse immunitaire dirigée à la fois contre les quatre sérotypes de la dengue, cet antigène pourrait constituer un candidat-vaccin de choix contre la dengue.
Illustration : Structure 3 D du complexe des anticorps spécifiques aux quatre sérotypes fixés à la protéine de l’enveloppe du virus de la dengue. © Institut Pasteur
Sources
Recognition determinants of broadly neutralizing human antibodies against dengue viruses, Nature, 12 janvier 2015. doi:10.1038/nature14130
Alexander Rouvinski (1,2*), Pablo Guardado-Calvo (1,2*), Giovanna Barba-Spaeth (1,2*), Stéphane Duquerroy (1,2,3), Marie-Christine Vaney (1,2), Carlos M. Kikuti (1,2), M. Erika Navarro Sanchez (1,2), Wanwisa Dejnirattisai (4), Wiyada Wongwiwat (4), Ahmed Haouz (5), Christine Girard-Blanc (5), Stéphane Petres (5), William E. Shepard (6), Philippe Desprès (7), Fernando Arenzana-Seisdedos (8), Philippe Dussart (9), Juthathip Mongkolsapaya (4,10), Gavin R. Screaton (4) & Félix A. Rey (1,2,5)
(1) Institut Pasteur, Département de Virologie, Unité de Virologie Structurale, 75724 Paris Cedex 15, France.
(2) CNRS UMR 3569 Virologie, 75724 Paris Cedex 15, France.
(3) Université Paris-Sud, Faculté des Sciences, 91405 Orsay, France.
(4) Division of Immunology and Inflammation, Department of Medicine, Hammersmith Hospital Campus, Imperial College London, London W12 0NN, UK.
(5) Institut Pasteur, Protéopôle, CNRS UMR 3528, 75724 Paris Cedex 15, France.
(6) Synchrotron SOLEIL, L’Orme des Merisiers, Saint Aubin, BP48, 91192 Gif-sur-Yvette, France.
(7) Institut Pasteur, Département de Virologie, Unité des Interactions Moléculaires Flavivirus-Hôtes, 75724 Paris Cedex 15, France.
(8) Institut Pasteur, Département de Virologie, Unité de Pathogénie Virale, INSERMU1108, 75724 Paris Cedex 15, France.
(9) Institut Pasteur de Guyane, BP 6010, 97306 Cayenne, French Guiana.
(10) Dengue Hemorrhagic Fever Research Unit, Office for Research and Development, Faculty of Medicine, Siriraj Hospital, Mahidol University, Bangkok 10700, Thailand.
* Ces auteurs ont contribué de manière équivalente au travail.
Recognition determinants of broadly neutralizing human antibodies against dengue viruses, Nature, 12 janvier 2015. doi: 10.1038/nature14130
Rouvinski A, Guardado-Calvo P, Barba-Spaeth G, Duquerroy S, Vaney MC, Kikuti CM, Sanchez ME, Dejnirattisai W, Wongwiwat W, Haouz A, Girard-Blanc C, Petres S, Shepard WE, Desprès P, Arenzana-Seisdedos F, Dussart P, Mongkolsapaya J, Screaton GR, Rey FA.
A new class of highly potent, broadly neutralizing antibodies isolated from viremic patients infected with dengue virus, Nature Immunology, 15 Décembre 2014. doi: 10.1038/ni.3058.
Dejnirattisai W, Wongwiwat W, Supasa S, Zhang X, Dai X, Rouvinsky A, Jumnainsong A, Edwards C, Quyen NT, Duangchinda T, Grimes JM, Tsai W, Lai C, Wang W, Malasit P, Farrar J, Simmons CP, Zhou ZH, Rey FA, Mongkolsapaya J, Screaton GR.