>> Un premier pas dans la mise au point d'une thérapeutique
Des chercheurs de l'Institut Pasteur, du CNRS, de l'INRA et de l'université Paris-Sud 11 publient dans la revue « SCIENCE » du 27 novembre 2009 la structure tridimensionnelle d'un complexe formé par l'ARN et une protéine du virus responsable de la bronchiolite. La structure de ce complexe éclaire sur la façon dont le virus se multiplie dans la cellule infectée. La bronchiolite virale atteint la majorité des enfants
avant l'âge de 3 ans, souvent à l'occasion d'une épidémie, et peut être à l'origine d'hospitalisations chez les personnes âgées ou immunodéprimées. À ce jour aucun vaccin n'est disponible. Un virus homologue est aussi responsable d'une maladie respiratoire des jeunes bovins, causant de lourdes pertes économiques dans les élevages. La résolution de la structure fine de ce complexe ARN-protéine ouvre donc de nouvelles voies dans la recherche d'une thérapeutique pouvant bloquer la multiplication de ce virus.
Communiqué de presse
Paris, le 27 novembre 2009
Le VRS est un virus dit "à ARN" qui stocke son matériel génétique sur une molécule d’ARN simple brin, contrairement à la plupart des autres êtres vivants qui portent leur information génétique sur une molécule d’ADN double brin. Cet ARN est lui-même enveloppé par une protéine, appelée nucléoprotéine. Lorsque le virus pénètre dans les cellules pulmonaires, il détourne la machinerie
cellulaire de l’hôte afin de produire un grand nombre de nouveaux exemplaires du virus qui peuvent infecter à leur tour d’autres cellules ou être transmis à un autre individu. Le rôle de la nucléoprotéine est à la fois de protéger l’ARN viral des défenses immunitaires de l’hôte durant son parcours au sein de la cellule, et de participer à sa multiplication en présentant l’ARN à l‘enzyme virale qui le recopie.
Pour étudier le fonctionnement de ce complexe protéine/ARN, les chercheurs l’ont cristallisé. En examinant les cristaux à l’aide d’un synchrotron, qui produit des rayons X très puissants, ils ont
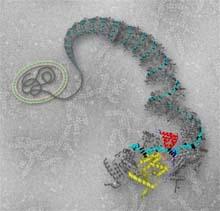
reconstitué grâce à un traitement informatique une image à haute résolution de la structure du complexe. Cette image détaillée montre comment les nucléoprotéines s’associent les unes aux autres, à l’aide de « bras » pour former une chaîne —un peu à la manière des rugbymen lors d’une mêlée– tout le long de l’ARN. Chaque nucléoprotéine est constituée de deux domaines qui se referment autour de l’ARN comme une pince. Ces deux domaines sont séparés par une charnière flexible. Les scientifiques ont émis l’hypothèse que lors de la multiplication virale, la pince s’ouvre et laisse uniquement passer l’enzyme, permettant une lecture de l’information génétique contenue dans la séquence d’ARN. L’ARN viral serait ainsi toujours protégé au sein de ce complexe.
Le rôle clé de la nucléoprotéine dans la multiplication du virus en fait une cible idéale pour la mise au point de médicaments, qui manquent cruellement pour traiter cette infection. En effet puisqu’elle doit s’ouvrir pour permettre un accès à l’information génétique, une molécule bloquant son ouverture constituerait un traitement de choix. De telles molécules interrompraient la réplication du virus et sa dissémination dans les voies respiratoires. L’image détaillée de sa structure tridimensionnelle, qui a fait l’objet d’un dépôt de brevet, va permettre le développement d’agents thérapeutiques potentiels, en fabriquant « sur mesure » des molécules capables d’inhiber la réplication virale. Ces travaux illustrent comment la recherche fondamentale sur la structure d’un virus peut avoir des applications médicales et vétérinaires.
--
Iconographie : structure tridimensionnelle de la nucléoprotéine du virus respiratoire syncytial. Le génome du virus est constitué d’une molécule d’ARN (noir et bleu turquoise) recouverte de la
nucléoprotéine constituée de deux lobes (rouge et jaune) se fermant comme une pince sur l’ARN. Deux bras (bleu foncé) permettent à la nucléoprotéine d’interagir avec les molécules voisines et de former une chaîne continue, cachant et protégeant ainsi l’ARN.
Source
Crystal structure of a Nucleocapsid-Like Nucleoprotein-RNA Complex of Respiratory Syncytial Virus. Science, 27 novembre 2009, vol. 326, pp. 1279-1283.
Rajiv G. Tawar(1), Stéphane Duquerroy (1, 2), Clemens Vonrhein (3), Paloma F. Varela (1), Laurence Damier-Piolle (1), Nathalie Castagné (4), Kirsty MacLellan (5), Hugues Bedouelle (6), Gérard Bricogne (3), David Bhella (4), Jean-François Eléouët (4) and Félix A. Rey (1).
(1) Institut Pasteur, Unité de Virologie structurale, département de Virologie et CNRS URA 3015, 25 rue du Dr Roux, 75724 Paris Cedex 15, France.
(2) Université Paris-Sud 11, Faculté des Sciences d’Orsay, 91405 Orsay Cedex, France.
(3) Global Phasing Ltd, Sheraton House, Castle Park, Cambridge CB3 0AX United Kingdom.
(4) INRA, Unité de Virologie et immunologie moléculaires, Domaine du Vilvert, 78350 Jouy-en-Josas, France.
(5) MRC Virology Unit, University of Glasgow, Church Street, Glasgow, G11 5JR, United Kingdom.
(6) Institut Pasteur, CNRS URA 3012, 25 rue du Dr Roux, 75724 Paris Cedex 15, France.
Contacts presse
Institut Pasteur - Marion Doucet – 01 45 68 89 28 – marion.doucet@pasteur.fr
INRA - Mathilde Maufras – 01 42 75 91 69 – presse@inra.fr
CNRS - Jonathan Rangapanaiken - 01 44 96 51 37 - jonathan.rangapanaiken@cnrs-dir.fr
Université Paris-Sud 11 - Emmanuelle Louis – 01 69 15 30 72 – emmanuelle.louis@u-psud.fr


