Une étude menée par Marc Lecuit(1) de l'Unité des Interactions Bactéries-Cellules de l'Institut Pasteur dirigée par le Pr Pascale Cossart, a permis de découvrir comment, chez la femme enceinte, la bactérie Listeria monocytogenes traverse la barrière placentaire. La traversée de la barrière placentaire entraîne des infections graves du fœtus, la mort fœtale in utero, des avortements, des naissances prématurées et des infections néo-natales.
Les résultats de cette étude sont publiés en ligne par PNAS. Ils sont le fruit d'une collaboration avec le Département d'Obstétrique et Gynécologie de la Washington University (Saint Louis, Missouri, Etats-Unis), l'unité d'Histotechnologie et Pathologie de l'Institut Pasteur, le service d'Anatomie et de Cytologie Pathologiques de Hôpital Cochin-Port-Royal (Assistance Publique Hôpitaux de Paris).
Communiqué de presse
Paris, le 6 avril 2004
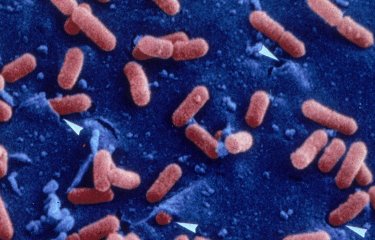
La listériose est une infection d’origine alimentaire causée par Listeria monocytogenes. Largement répandue dans la nature (eau, sol, végétaux, animaux) cette bactérie peut contaminer de nombreux aliments : légumes crus, plats cuisinés prêts à la consommation, fromage, charcuterie. La listériose menace en premier lieu les femmes enceintes, les enfants à naître et les nouveau-nés. Les personnes âgées et les personnes immunodéprimées sont également des sujets à risque. Chez ces individus, elle est responsable de septicémies, de méningites et d’encéphalites. L’antibiothérapie est dans la plupart des cas efficace mais la mortalité atteint encore 30% des individus infectés. Chez l’adulte sain, les symptômes sont en général moins graves et peuvent se traduire par une simple gastro-entérite.
L’infection débute par l’ingestion d’aliments contaminés par Listeria monocytogenes qui peut ensuite traverser la barrière intestinale et atteindre la circulation sanguine. La bactérie est alors capable de passer la barrière hémato-encéphalique et la barrière placentaire chez la femme enceinte.
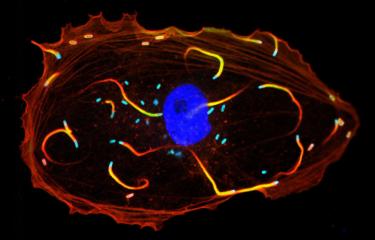
Marc Lecuit de l’Unité des Interactions Bactéries-Cellules de l’Institut Pasteur dirigée par le Pr Pascale Cossart vient de démontrer comment l’interaction entre une protéine de Listeria monocytogenes, l’internaline, et son récepteur cellulaire, la E-cadhérine, permet à la bactérie de franchir la barrière placentaire humaine*.
Le rôle clé de l’internaline dans l’infection materno-fœtale humaine a tout d’abord été suggéré par les résultats d’une étude épidémiologique menée en collaboration avec le Centre National de Référence des Listeria**. En effet, sur 300 souches cliniques étudiées, tous les isolats bactériens provenant de femmes enceintes exprimaient cette protéine fonctionnelle alors qu’elle n’était présente que dans 65% des souches d’origine alimentaire.
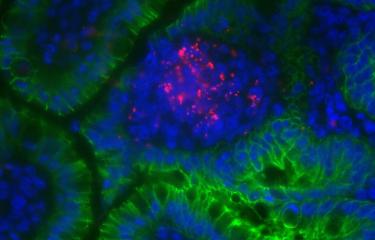
Pour confirmer l’hypothèse d’un rôle crucial de l’internaline dans l’infection materno-fœtale, les chercheurs ont tout d’abord examiné des placentas provenant de femmes atteintes de listériose et ont observé que des bactéries adhéraient aux cellules de la barrière placentaire et traversaient la barrière placentaire. Cette invasion a pour conséquence une perturbation des échanges materno-fœtaux au niveau placentaire et provoque une infection responsable d’avortements, d’accouchements prématurés ou d’infections néonatales.
Les chercheurs ont ensuite mis en évidence que le récepteur de l’internaline de Listeria monocytogenes, la E-cadhérine, était exprimé au niveau de la barrière placentaire et était accessible aux bactéries présentes dans le sang maternel. Des expériences utilisant des cellules placentaires en culture, ou du tissu placentaire cultivé ex vivo ont permis de démontrer que l’infection de ces tissus et le franchissement de la barrière placentaire étaient dépendantes de l’interaction internaline-E-cadhérine.
C’est la première fois que le mécanisme moléculaire permettant à une bactérie pathogène de franchir la barrière placentaire est ainsi découvert.
Cette équipe s’intéresse aussi au mécanisme de franchissement de la barrière hémato-encéphalique. Son hypothèse de travail est que l’internaline pourrait aussi jouer un rôle pour infecter le système nerveux central. Ainsi, l’internaline serait l’élément clé qui permet de comprendre pourquoi Listeria cible spécifiquement trois organes dans l’espèce humaine : le tissu intestinal, l’unité fœtoplacentaire et le système nerveux central.
Les travaux publiés aujourd’hui permettent non seulement de mieux comprendre les déterminants moléculaires du pouvoir pathogène de Listeria monocytogenes, mais pourraient aussi permettre de cibler des molécules d’intérêt diagnostique ou thérapeutique au niveau de l’interface maternofœtale.
(1) Marc Lecuit, Unité des Interactions Bactéries-Cellules de l’Institut Pasteur, chef de clinique assistant dans le service des Maladies infectieuses et tropicales, Hôpital Necker.
* C’est l’équipe de Pascale Cossart qui avait identifié, dans des études précédentes, l’internaline, ainsi que son récepteur humain, la E-cadhérine, et démontré que l’interaction entre ces deux protéines permettait à la bactérie d’entrer dans les cellules. En 2001, Marc Lecuit dans l’équipe de Pascale Cossart, en collaboration avec Charles Babinet, chef de l’unité de Biologie du Développement avait mis au point un modèle de souris transgéniques exprimant la E-cadhérine humaine et découvert que c’est la liaison entre l’internaline et son récepteur la E-cadhérine qui permet à la bactérie de traverser la barrière intestinale et d’accéder à la circulation sanguine pour y provoquer l’infection systémique (voir le communiqué de presse du 1er juin 2001)
** A l’Institut Pasteur, le Centre National de Référence des Listeria est chargé de la surveillance microbiologique de la listériose humaine. Lors d’épidémies, il participe au dispositif associant la Direction Générale de la Santé, l’Institut de Veille Sanitaire, la Direction Générale de l’Alimentation et la Direction Générale de la Concurrence, de la Consommation et de la Répression des Fraudes.
Sources
" Targeting and crossing of the human maternofetal barrier by Listeria monocytogenes : Role of internalin interaction with trophoblast E-cadherin " PNAS
Marc Lecuit (1), D. Michael Nelson (2), Steve D. Smith (2), Huot Khun (3), Michel Huerre (3), Marie-Cécile Vacher-Lavenu (4), Jeffrey I. Gordon (5) and Pascale Cossart (1)
1 - Unité des Interactions Bactéries-Cellules, Institut Pasteur, Paris
2 - Obstetrics and Gynecology Department, Washington University, Saint Louis, Missouri, Etats-Unis
3 - Unité d’Histotechnologie et Pathologie, Institut Pasteur, Paris
4 - Service d’Anatomie et de Cytologie Pathologiques, Hôpital Cochin-Port Royal, Assistance Publique Hôpitaux de Paris
5 - Département de Biologie moléculaire et Pharmacologie Washington University, Saint Louis, Missouri, Etats-Unis
Contact presse
Service de presse
Nadine Peyrolo
01 45 68 81 47 - npeyrolo@pasteur.fr
Bruno Baron
01 44 38 91 30 - bbaron@pasteur.fr