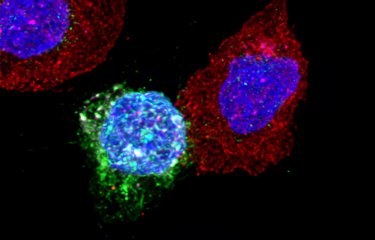
Un récepteur de l’immunité normalement connu pour identifier l’ARN viral est aussi capable de se lier avec de l’ARN cellulaire pour mettre en place des défenses immunitaires. Ce mécanisme pourrait servir à déclencher l’immunité avant que le virus ne soit détectable.
Les virus à ARN, comme les virus de la grippe, le SARS-CoV-2 responsable de la Covid-19, ou encore le VIH, constituent l’une des principales menaces auxquelles le système immunitaire doit faire face. Dans une étude récente publiée dans la revue iScience, des équipes de recherche françaises et américaines se sont intéressé aux mécanismes de l’immunité innée face aux virus à ARN. Cette publication montre que certains récepteurs immunitaires qui détectent la présence d’ARN viral sont aussi activés par de l’ARN produit par nos cellules. Cela permettrait à la cellule de réagir plus tôt à l’infection.
Un mécanisme évolutif conservé contre les virus à ARN
Lors d’une l’infection, l’ARN des virus est introduit dans le cytoplasme des cellules, afin qu’il soit lu et traduit en protéines, qui formeront de nouveaux virus. Afin de parer cette réplication, les cellules humaines expriment les récepteurs immunitaires cytoplasmique de type RIG-I, qui constituent la première ligne de défense contre les infections virales. Les molécules d’ARN se lient à ces récepteurs, ce qui déclenche des mécanismes de défense de l’immunité innée contre l’infection. Si l’on croyait jusque-là que ces récepteurs n’étaient sensibles qu’à l’ARN des virus, cette nouvelle étude montre que les cellules sont capables de produire des molécules d’ARN dits endogènes capables eux aussi de les activer. Cet ARN endogène présente une structure qui imite l’ARN viral afin de se faire reconnaître par les récepteurs RIG-I.
Dans cette étude, les chercheurs ont étudié les réactions immunitaires suscitées par l’infection par les virus de la dengue et de la rougeole, qui causent des infections aigües, mais aussi du VIH, provoquant une infection chronique. Ils ont ainsi montré que c’est le même type d’ARN endogène qui est impliqué dans le déclenchement l’immunité innée pour des infections différentes, ce qui montre que ce mécanisme a été très conservé au cours de l’évolution pour se protéger des infections virales. En effet, les chercheurs font l’hypothèse que ce reconnaissance d’ARN endogène sert à la cellule à prendre de cours l’infection et à déclencher l’immunité avant que le virus ne se soit suffisamment répliqué pour être détecté directement. Les cellules possèdent donc des mécanismes de défense qu’elles déclenchent elles-mêmes pour parer l’infection.
Une voie de signalement modulée par la présence du virus
Les résultats de l’étude montrent également que ces ARN endogènes sont toujours présents dans les cellules, mais qu’en temps normal, ils ne se lient pas aux récepteurs RIG-I, et ne sont détectés que lorsqu’une infection virale se déclare. Mais comment ces ARN parviennent-ils à signaler l’infection en temps voulu si le virus n’a pas été détecté par les récepteurs ? Pour le moment, tous les mécanismes n’ont pas encore été éclaircis, mais il semblerait que la présence du virus interfère dans certaines voies biochimiques cellulaires qui détermine le pouvoir immunogène, c’est-à-dire la capacité à déclencher une réponse immunitaire, des ARN endogènes. Quand la cellule est infectée, cela modifie des processus qui conduisent à l’apparition d’ARN endogènes, les rendant capables de se lier aux récepteurs RIG-I. Il s’agit donc d’un processus actif, dans lequel l’hôte réagit à la présence ou non de virus dans ses cellules afin de déclencher la réponse immunitaire, grâce à l’ARN endogène.
Ces recherches offrent de nouvelles clefs pour comprendre les infections par les virus à ARN et la réponse immunitaire innée qui y ait opposée. En particulier, l’étude décrit en particulier le cas d’une infection par le VIH, qui tire profit de ce mécanisme. Cette étude est basée sur une coopération internationale franco-américaine et associe la biologie moléculaire, la biologie cellulaire et l’étude clinique de patients atteints par le VIH pour repenser notre modèle de l’immunité.
Cette étude entre dans le cadre de l’axe scientifique prioritaire Maladies infectieuses émergentes du plan stratégique 2019-2023 de l’Institut Pasteur.
Source :
Y RNAs are conserved endogenous RIG-I ligands across RNA virus infection and are targeted by HIV-1, iScience, 15 juillet 2022
Nicolas Vabret1,2,10, Valérie Najburg3, Alexander Solovyov12, Ramya Gopal1,2,10, Christopher McClain1,2,10, Petr Šulc4, Sreekumar Balan1,2,10, Yannis Rahou5, Guillaume Beauclair3, Maxime Chazal3, Hugo Varet6,7, Rachel Legendre6,7, Odile Sismeiro6, Raul Y. Sanchez David3, Lise Chauveau8, Nolwenn Jouvenet3, Martin Markowitz9, Sylvie van der Werf5, Olivier Schwartz8, Frédéric Tangy3, Nina Bhardwaj1,2,10,11, Benjamin D. Greenbaum12,13, et Anastassia V. Komarova3,5
1 - Tisch Cancer Institute, Icahn School of Medicine at Mount Sinai, New York, NY, USA
2 - Precision Immunology Institute, Icahn School of Medicine at Mount Sinai, New York, NY 10029, USA
3 - Viral Genomics and Vaccination Unit, Department of Virology, Institut Pasteur, Université de Paris, CNRS UMR-3569, 75015 Paris, France
4 - Center for Molecular Design and Biomimetics at the Biodesign Institute and School of Molecular Sciences, Arizona State University, Tempe, AZ 85287, USA
5 - Molecular Genetics of RNA Viruses, Department of Virology, Institut Pasteur, Université de Paris, CNRS UMR-3569, 75015 Paris, France
6 - Transcriptome and EpiGenome Platform, BioMics, Center of Innovation and Technological Research, Institut Pasteur, Université de Paris, 28 rue du Docteur Roux, 75724 Paris Cedex 15, France
7 - Hub Informatique et Biostatistique, Centre de Bioinformatique, Biostatistique et Biologie Intégrative (C3BI, USR 3756 IP-CNRS), Institut Pasteur, Université de Paris, 28 Rue du Docteur Roux, 75724 Paris Cedex 15, France
8 - Virus & Immunity Unit, Department of Virology, Institut Pasteur, Université de Paris, CNRS UMR-3569, 75015 Paris, France
9 - Aaron Diamond AIDS Research Center, TheRockefeller University, New York, NY, USA
10 - Department of Medicine, Hematology and Medical Oncology, Icahn School of Medicine at Mount Sinai, New York, NY 10029, USA
11 - Extra-mural Member, Parker Institute of Cancer Immunotherapy, USA
12 - Computational Oncology, Department of Epidemiology and Biostatistics, Memorial Sloan Kettering Cancer Center, New York, NY 10065, USA
13 - Physiology, Biophysics, & Systems Biology, Weill Cornell Medicine, New York, NY 10065, USA