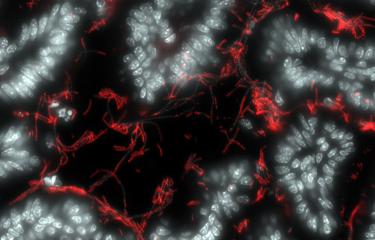
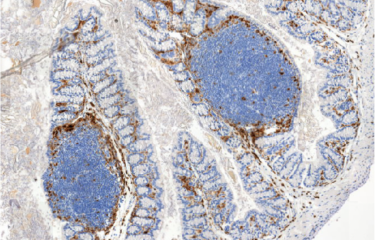
De nombreuses données épidémiologiques font déjà le lien entre l’obésité et les maladies inflammatoires chroniques de l’intestin. Face à l’augmentation de la prévalence de l’obésité dans le monde, il devient nécessaire de comprendre les mécanismes par lesquels cette obésité entraîne des complications. Les chercheurs de l’unité Microenvironnement et immunité à l’Institut Pasteur viennent de montrer qu’une alimentation trop grasse ou excessive, tôt dans la vie, augmente significativement le risque de développer des maladies inflammatoires. La compréhension de ce phénomène d’« empreinte pathologique », qui reste depuis l’enfance, marque un premier pas vers d’autres recherches avant d’en tirer un jour de potentielles mesures préventives.
L’obésité, en particulier l’obésité infantile, est un facteur de risque connu de développer à l’âge adulte des désordres métaboliques et les pathologies qui leur sont associées comme l’athérosclérose, l’hypertension, diabète de type 2 et la maladie dite du « foie gras ». Les scientifiques évoquent plusieurs pistes pour lier l’obésité à la prédisposition aux différentes maladies inflammatoires :
- le transfert et le développement d’un microbiote déséquilibré ;
- des modifications épigénétiques ;
- des mutations de gènes responsables du contrôle de l’inflammation.
De précédents travaux des chercheurs de l’unité Microenvironnement et immunité avaient déjà montré, chez le modèle animal, qu’une réponse immunitaire importante se produisait lors de l’introduction de nourriture solide et du développement du microbiote. « Nous avions montré que cette réaction immunitaire était essentielle car elle participait à l’éducation du système immunitaire, et permettait, à l’âge adulte, une faible susceptibilité aux maladies inflammatoires », explique Gérard Eberl, responsable de l’unité à l’Institut Pasteur. Pourtant, l’impact de l’alimentation précoce sur le système immunitaire et les conséquences pour la santé future reste à déterminer.
Un premier pas vers la compréhension de « l’empreinte pathologique »
Dans de nouveaux travaux, tout juste publiés dans Nature Metabolism, les chercheurs montrent, toujours chez le modèle animal, que l’exposition à une alimentation excessive avant le sevrage augmenterait la perméabilité de l’intestin ainsi que l’expression de molécules inflammatoires appelées cytokines. « Nous démontrons qu’une alimentation excessive ou trop grasse "nourrit" certaines bactéries, casse des liaisons entre protéines [appelées « ponts disulfure »] et déséquilibre le mucus intestinal », explique Gérard Eberl. Ces perturbations moléculaires favorisent la susceptibilité à long terme de développer une colite. Les chercheurs montrent par ailleurs que cette susceptibilité peut être supprimée en inhibant ces perturbations.
Ces recherches sont la première étape vers d’autres travaux : « Il faut maintenant définir quel type de nourriture en particulier a un impact, définir un seuil alimentaire, identifier les bactéries responsables de ces perturbations pour comprendre la différence entre le physiologique et le pathologique », souligne Gérard Eberl.
L’ensemble de ces données suggère qu’il existe une « empreinte pathologique ». « Il est intéressant de constater que des mécanismes se produisant très tôt dans la vie ont une influence à long terme sur la santé. Le corps possède une sorte de mémoire. Il nous reste à savoir s’il est possible de la corriger », conclut Gérard Eberl.

Légendes de l'illustration :
1- La nourriture grasse permet aux bactéries de proliférer
2- Les ponts disulfures sont cassés par les bactéries
3- Le mucus intestinal est déstabilisé
4- Les bactéries pénètrent le mucus
5- Cette inflammation marque le système immunitaire à long terme
Source
Excess calorie intake early in life increases susceptibility to colitis in adulthood, Nature Metabolim, 4 novembre 2019
Ziad Al Nabhani1,2, Sophie Dulauroy1,2, Emelyne Lécuyer1,2, Bernadette Polomack1,2, Pascal Campagne3, Marion Berard4 and Gérard Eberl1,2
1 Institut Pasteur, Microenvironment & Immunity Unit, Paris, France
2 INSERM U1224, Paris, France
3 Hub de Bioinformatique et Biostatistique, Département de Biologie Computationnelle, Institut Pasteur, USR 3756 CNRS, Paris, France
4 Institut Pasteur, DTPS, Animalerie Centrale, Centre de Gnotobiologie, Paris, France