Des chercheurs de l’Institut Pasteur, du CNRS et du Vaccine Research Institute (ANRS/Inserm) viennent de montrer que certains anticorps très performants peuvent reconnaître les cellules infectées par le virus du sida (VIH) et entraîner leur destruction par le système immunitaire. Cette découverte permet de mieux comprendre le mécanisme d’action de ces anticorps particuliers qui sont en cours d’essai clinique. Ces résultats sont publiés dans Nature communications le 3 mars 2016.
Le sida est une maladie infectieuse causée par le virus de l’immunodéficience humaine (VIH). On estime que 1,2 millions de personnes sont décédées du sida l’année dernière et que près de 35 millions sont aujourd’hui infectées par le virus, plaçant le sida en tête des maladies infectieuses les plus meurtrières au monde (OMS, 2015). Pour combattre cette maladie, des traitements antirétroviraux existent mais, faute de moyens, seulement 16 millions de personnes y ont accès en 2015. De plus, le virus n’est pas complètement éliminé par ces traitements : il peut se multiplier à bas bruit et constituer ce qu’on appelle un réservoir viral. En cas d’interruption du traitement anti rétroviral, ce réservoir peut être la source d’une nouvelle multiplication virale dans l’organisme, même après de nombreuses années de thérapie. Il est donc important de mieux comprendre les mécanismes qui régulent la formation de ce réservoir et de déterminer des stratégies pour l’éliminer.
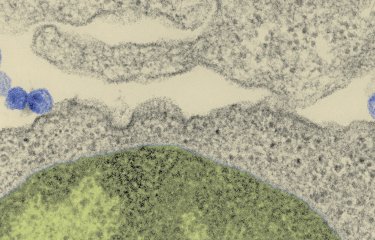
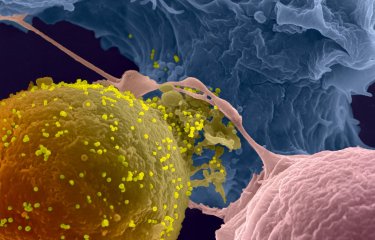
Chez certains patients infectés, des anticorps particuliers ont été identifiés pour leur capacité à bloquer la réplication de très nombreuses souches de VIH-1. En étudiant le mécanisme d’action de ces anticorps dits « neutralisants à large spectre » (bNAbs), les chercheurs de l’équipe d’Olivier Schwartz de l’unité « Virus et immunité » (Institut Pasteur / CNRS), cofinancée par le Vaccine Research Institute (VRI, ANRS/Inserm) et du groupe « Réponse humorale aux pathogènes » (Institut Pasteur / CNRS), dirigé par Hugo Mouquet, en collaboration avec l’équipe d’Olivier Lambotte (Hôpital Bicêtre), ont démontré qu’ils agissent de façons complémentaires. Tout d’abord, les bNAbs neutralisent la propagation du virus, et notamment son passage de cellule à cellule. Mais ils sont également capables, pour les plus efficaces d’entre eux, de reconnaître directement les cellules infectées et d’entraîner leur destruction par les cellules Natural Killer (NK), cellules du système immunitaire chargées d’éliminer les cellules anormales de l’organisme. Pour cela, les bNAbs peuvent reconnaître différentes parties de l’enveloppe virale exposées à la surface des cellules humaines. Les scientifiques ont observé que l’exposition de ces différentes parties de l’enveloppe est très variable à la surface des cellules infectées, et dépend de la souche de VIH, modulant donc la réponse des cellules immunitaires. Ils ont observé que la combinaison de différents bNAbs permet d’augmenter leur efficacité pour recruter des cellules NK. Enfin, les chercheurs ont montré que les cellules provenant du réservoir viral de patients sont également reconnues par les bNAbs, à des niveaux généralement suffisants pour entrainer leur élimination.

Olivier Schwartz, Responsable de l’unité Virus et immunité (Institut Pasteur / CNRS)
Ce travail représente une étape importante dans la compréhension du mécanisme d’action des anticorps neutralisants à large spectre. Il définit les paramètres contrôlant les capacités de ces anticorps à recruter des cellules immunitaires et conforte l’idée qu’ils pourraient réduire le réservoir chez les patients infectés par le VIH
La caractérisation de ces anticorps bNAbs est importante pour différentes raisons. La façon dont ils reconnaissent l’enveloppe virale donne en effet des informations précieuses pour la conception de candidats vaccins. De plus, il a déjà été démontré que les bNAbs peuvent être utilisés chez l’homme. Les plus efficaces sont actuellement en cours d’essai clinique aux Etats-Unis pour leur faculté à abaisser significativement la charge virale pendant 28 jours. Ces immunothérapies représentent donc de nouvelles stratégies thérapeutiques ou préventives prometteuses.
Ces travaux ont été financés par l’ANRS, le LabEx Vaccine Research Institute (ANR-10-LABX-77), Sidaction, la Fondation Areva, le LabEx IBEID, le LabEx Milieu Intérieur, le 7e programme cadre européen, et l’European Research Council (ERC).
Source
Elimination of HIV-1-infected cells by broadly neutralizing antibodies, Nature Communications, 3 mars 2016. DOI : 10.1038/NCOMMS10844
Timothée Bruel (1,2), Florence Guivel-Benhassine (1,2), Sonia Amraoui (1,2), Marine Malbec (3,4), Léa Richard (1,2), Katia Bourdic (5,6,7,8), Daniel Aron Donahue (1,2), Valérie Lorin (3,4), Nicoletta Casartelli (1,2), Nicolas Noel (5,6,7,8), Olivier Lambotte (5,6,7,8), Hugo Mouquet (3,4) & Olivier Schwartz (1,2,9)
(1) Virus and Immunity Unit, Department of Virology, Institut Pasteur, Paris 75015, France.
(2) CNRS-URA 3015, Paris, France.
(3) Laboratory of Humoral Response to Pathogens, Department of Immunology, Institut Pasteur, Paris 75015, France.
(4) CNRS-URA 1961, Paris, France.
(5) Université Paris Sud, UMR-1184, France.
(6) CEA, DSV/iMETI, Division of Immuno-Virology, IDMIT, France.
(7) Inserm, U1184, Center for Immunology of Viral Infections and Autoimmune Diseases, France.
(8) APHP, Service de Médecine Interne–Immunologie Clinique, Hôpitaux Universitaires Paris Sud, le Kremlin Bicêtre, France.
(9) Vaccine Research Institute, Creteil, France.