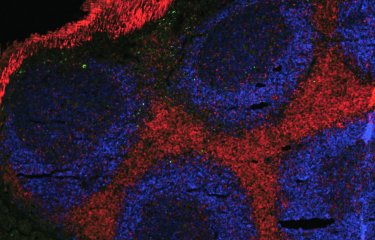
Un modèle de cellules souches permet à des chercheurs d’observer les premières étapes de la détermination du sexe chez les humains. Leurs travaux pourraient aider à découvrir pourquoi certaines personnes naissent sans sexe clairement identifiable à la naissance, et à développer de futurs traitements de fertilité.
On sait très peu de choses sur ce qui se passe lorsque la constitution génétique d’un individu ne correspond pas à son sexe physique. Il existe un éventail de conditions appelées différences de développement sexuel (DSD), qui surviennent chez 1 nouveau-né sur 4 500 et sont souvent associées à l'infertilité. Le développement des gonades chez l'homme est mal compris car les gènes impliqués ne sont pas conservés au cours de l'évolution et le tissu de la gonade en développement précoce est difficile d'accès chez l'homme. Les progrès dans ce domaine ont été progressifs en raison de l'absence d'un système de modèle approprié et accessible.
Des chercheurs de l’Institut Pasteur (Anu Bashamboo dans l’unité de Génétique du développement humain dirigée par Kenneth McElreavey), du Francis Crick Institute (Robin Lovell-Badge), et de l’Université Bar-Ilan (Nitzan Gonen), ont développé un modèle de développement précoce des gonades, en utilisant des cellules souches pluripotentes induites, qui peuvent être dirigées pour devenir n’importe quel type de cellule dans le corps. À partir de ces cellules, en utilisant de nouveaux protocoles de culture, ils ont généré des cellules somatiques gonadiques qui deviendront les précurseurs des ovaires ou des testicules. À l’aide de leur modèle, les chercheurs de Pasteur ont cultivé des cellules gonadiques somatiques avec des chromosomes mâles (XY), portant une variante génétique d’un gène spécifique connu pour provoquer l’inversion sexuelle. Ces cellules étaient incapables de former du tissu testiculaire 3D sur un dispositif microfluidique spécialement conçu et semblaient plus proches des cellules ovariennes.
Ces dernières années, l'équipe Pasteur a identifié plusieurs nouveaux gènes impliqués dans la détermination du sexe humain (e.g. Découverte de la cause génétique de la différence de développement sexuel). Cependant, il leur manquait un modèle biologique adapté pour étudier les mécanismes par lesquels les variants de ces gènes pourraient provoquer des pathologies humaines du testicule. Combiné aux techniques d'édition du génome, le nouveau modèle permet désormais aux chercheurs d'étudier les rôles d'une gamme de gènes différents supposés être impliqués dans la détermination du sexe, le développement des gonades et les pathologies associées, notamment la DSD et l'infertilité. Leur découverte pourrait non seulement aider à découvrir pourquoi certaines personnes naissent sans sexe clairement identifiable à la naissance, mais ce nouveau modèle pourrait être utilisé comme plateforme de spermatogenèse menant au développement de futurs traitements de fertilité.
Pour en savoir plus (en anglais) : Stem cell model allows researchers to observe the earliest stages of sex determination in humans | Crick
Source :
In vitro cellular reprogramming to model gonad development and its disorders, Science advances, 4 janvier 2023.
DOI: 10.1126/sciadv.abn9793
Nitzan Gonen1,2†*, Caroline Eozenou3, †, Richard Mitter4, Maëva Elzaiat3, , Isabelle Stévant1,
Rona Aviram1, Andreia Sofia Bernardo2,5, Almira Chervova6, Somboon Wankanit3, Emmanuel Frachon7, Pierre-Henri Commère8, Sylvie Brailly-Tabard9, Léo Valon10, Laura Barrio Cano8, Romain Levayer10, Inas Mazen11, Samy Gobaa7, James C. Smith2, Kenneth McElreavey3*, Robin Lovell-Badge2*, Anu Bashamboo3*
1. The Mina and Everard Goodman Faculty of Life Sciences and the Institute of Nanotechnology and Advanced Materials, Bar-Ilan University, Ramat Gan 5290002, Israel.
2. The Francis Crick Institute, 1 Midland Road, London NW1 1AT, UK.
3. Institut Pasteur, Université de Paris, CNRS UMR3738, Human Developmental Genetics, F-75015 Paris, France.
4. Bioinformatics Core, The Francis Crick Institute, 1 Midland Road, London NW1 1AT, UK.
5. National Heart and Lung Institute, Imperial College London, London, UK.
6. Department of Stem Cell and Developmental Biology, Institut Pasteur, Paris 75724, France.
7. Biomaterials and Microfluidics Core Facility, Institut Pasteur, F-75015 Paris, France.
8. Cytometry and Biomarkers, Centre de Ressources et Recherches Technologiques (C2RT), Institut Pasteur, F75015 Paris, France.
9. Assistance Publique-Hôpitaux de Paris, Bicêtre Hospital, Molecular Genetics, Pharmacogenetics, and Hormonology, Le Kremlin-Bicêtre, France.
10. Institut Pasteur, Université de Paris, CNRS UMR3738, Cell Death and Epithelial Homeostasis, F-75015 Paris, France.
11. Genetics Department, National Research Center, Cairo, Egypt.
†These authors contributed equally to this work.