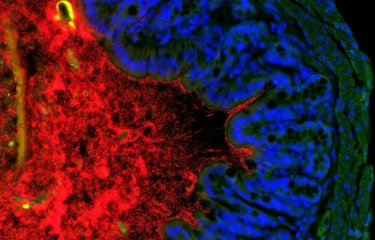
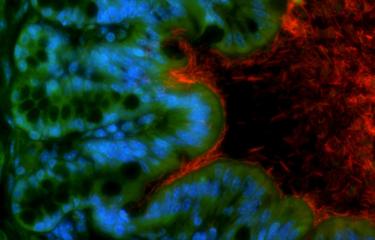
Des chercheurs de l’Institut Pasteur, en collaboration avec l’Institut Gustave-Roussy, ont identifié deux espèces bactériennes de notre organisme, Enterococcus hirae et Barnesiella intestinihominis, qui potentialisent l’effet d’un traitement courant de chimiothérapie : le cyclophosphamide. Les scientifiques avaient déjà prouvé récemment le rôle de notre microbiote dans l’efficacité des chimiothérapies. Cette fois-ci, ils ont caractérisé deux bactéries responsables de cette activité.
Le cyclophosphamide est une molécule de chimiothérapie, couramment utilisée dans le traitement de plusieurs cancers (du poumon, du sein, de l’ovaire, etc.). Il figure d’ailleurs dans la liste des « médicaments essentiels » de l’Organisation mondiale de la santé (OMS), c’est-à-dire ceux qui satisfont aux besoins de santé de la population. On sait que l’un des effets secondaires fréquent du cyclophosphamide est l’inflammation des muqueuses intestinales. La barrière intestinale est fragilisée. Les bactéries de notre intestin (microbiote) franchissent alors cette barrière et passent dans la circulation sanguine et les ganglions lymphatiques. L’organisme identifie généralement ces envahisseurs pour les éliminer, mais les patients sous chimiothérapie sont souvent aussi sous antibiotiques pour éviter l’infection.
Paradoxe de cette inflammation de l’intestin, nos bactéries intestinales viennent en renfort de la chimiothérapie (découverte de l’Institut Pasteur et de l’Institut Gustave-Roussy, en 2013). « L’efficacité de la chimiothérapie repose en partie sur des bactéries intestinales appelées "oncomicrobiotiques" », explique Ivo Gomperts Boneca, responsable du laboratoire Biologie et génétique de la paroi bactérienne à l’Institut Pasteur.
Jusqu’à présent, on ne savait pas quelles bactéries, parmi les milliards de notre microbiote, franchissaient la barrière intestinale et aidaient à la destruction de la tumeur. Dans l’étude qui vient de paraître début octobre, les mêmes chercheurs de l’Institut Pasteur (Paris), de l’Institut Pasteur de Lille et de l’Institut Gustave-Roussy ont identifié deux espèces bactériennes, Enterococcus hirae et Barnesiella intestinihominis, qui entrent en jeu au cours du traitement par cyclophosphamide.
« On s’est aperçu que, chez la souris, si l’écosystème microbien est déséquilibré, à l’image de ce qui se passe au cours d’une chimiothérapie, la bactérie Enterococcus hirae va modifier l’environnement proche de la tumeur et rétablit une réponse adéquate des lymphocytes T [cellules immunitaires, NDLR] contre la tumeur », poursuit Ivo Gomperts Boneca. Ce mécanisme d’action restait jusqu’à présent une énigme. La bactérie contribue donc à empêcher la progression de la tumeur. Par ailleurs, les chercheurs ont prouvé que Barnesiella intestinihominis est impliquée dans l’établissement d’une mémoire immunitaire contre les tumeurs.
Ainsi, Enterococcus hirae renforce la réponse immunitaire naturelle de l’organisme contre la tumeur. Cet effet bénéfique de l’entérocoque est transitoire mais Barnesiella maintient cette réponse sur le long terme.

Une photo d’Enterococcus hirae, produite à l’Ultrapole de l’Institut Pasteur. © Chantal Ecobichon / Institut Pasteur
Autre aspect de la découverte 2016 : sur une cohorte de 16 patients atteints de cancer du poumon et de l’ovaire à stades avancés, et traités par cyclophosphamide, les chercheurs ont observé que ceux chez qui les bactéries Enterococcus hirae et Barnesiella intestinihominis étaient présentes répondaient mieux au traitement.
Donc, Enterococcus hirae et Barnesiella intestinihominis sont des bactéries de notre organisme précieuses pour améliorer l’efficacité d’un des traitements les plus courants en chimiothérapie. « Il y a probablement d’autres bactéries utiles dans notre microbiote, reprend Ivo Gomperts Boneca. On constate que tous les patients sous chimiothérapie ne réagissent pas de la même façon au traitement. On peut l’expliquer par le fait que chaque individu possède son propre microbiote, pas forcément composé des mêmes bactéries. »
De ce constat, deux questions émergent : pourrait-on « donner » les bactéries manquantes aux patients qui ne les ont pas ? Ou, si ce n’est les bactéries elles-mêmes, au moins les composants de la bactérie impliqués dans cette activité anti-cancer ? « C’est cette dernière piste que nous creusons, poursuit le chercheur. Car injecter les bactéries elles-mêmes dans le microbiote constitue un risque d’infection. Nous souhaitons donc caractériser les molécules responsables de cette activité, pour mimer l’action des bactéries. »
Cette piste confirme la possibilité d’une médecine personnalisée dans le traitement des cancers, pour tenter d’aider les patients qui, aujourd’hui, répondent mal au traitement chimiothérapique.
Source
Enterococcus hirae and Barnesiella intestinihominis involved in cyclophosphamide-induced therapeutic immunomodulatory effects, Immunity, 18 octobre.
Romain Daillère1,2,3, Marie Vétizou1,2,3, Nadine Waldschmitt4, Takahiro Yamazaki1,2, Christophe Isnard5,6, Vichnou Poirier-Colame1,2,3, Connie P. M. Duong1,2,7, Caroline Flament1,2,7, Patricia Lepage8, Maria Paula Roberti1,2,7, Bertrand Routy1,2,3, Nicolas Jacquelot1,2,3, Lionel Apetoh9,10,11, Sonia Becharef1,2,7, Sylvie Rusakiewicz1,2,7, Philippe Langella8, Harry Sokol8,12,13, Guido Kroemer14,15,16,17,18,19, David Enot1,15, Antoine Roux1,2,3,18, Alexander Eggermont1,3, Eric Tartour20,21, Ludger Johannes22,23,24, Paul-Louis Woerther25, Elisabeth Chachaty25, Jean-Charles Soria1,3, Benjamin Besse1,3, Encouse Golden26, Silvia Formenti26, Magdalena Plebanski27, Mutsa Madondo27, Philip Rosenstiel28, Didier Raoult29, Vincent Cattoir*5,6,30, Ivo Gomperts Boneca*31, Mathias Chamaillard*4 and Laurence Zitvogel1,2,3,7.
1 Institut de Cancérologie Gustave Roussy Cancer Campus (GRCC), 114 rue Edouard Vaillant, Villejuif, 94805, France ;
2 Institut National de la Santé Et de la Recherche Medicale (INSERM), U1015, GRCC, Villejuif, 94805, France ;
3 University of Paris-Saclay, Kremlin Bicêtre, 94270, France ;
4 Institut Pasteur de Lille, Center for Infection and Immunity of Lille, Lille, 59800, France ;
5 Université de Caen Basse-Normandie, EA4655 U2RM (Équipe Antibio-Résistance), Caen, 14033, France ;
6 CHU de Caen, Service de Microbiologie, Caen, 14033, France ;
7 Center of Clinical Investigations in Biotherapies of Cancer (CICBT) 1428, Villejuif, 94805, France ;
8 Micalis Institute, INRA, AgroParisTech, Université Paris-Saclay, 78350 Jouy-en-Josas, France ;
9 Lipids, Nutrition, Cancer, INSERM, U866, Dijon, 21078, France ;
10 Department of Medicine, Université de Bourgogne Franche-Comté, Dijon, 21078, France ;
11 Department of Oncology, Centre Georges François Leclerc, Dijon, 21000, France ;
12 AVENIR Team Gut Microbiota and Immunity, ERL, INSERM U 1157/UMR 7203, Faculté de Médecine, Saint-Antoine, Université Pierre et Marie Curie (UPMC), Paris, 75012, France ;
13 Service de Gastroentérologie, Hôpital Saint-Antoine, Assistance Publique—Hôpitaux de Paris (APHP), Paris, 75012, France ;
14 INSERM U848, 94805 Villejuif, France ;
15 Metabolomics Platform, Institut Gustave Roussy, Villejuif, 94805, France ;
16 Equipe 11 labellisée Ligue contre le Cancer, Centre de Recherche des Cordeliers, INSERM U 1138, Paris, 75006, France ;
17 Pôle de Biologie, Hôpital Européen Georges Pompidou, AP-HP, Paris, 75015, France ;
18 Université Paris Descartes, Sorbonne Paris Cité, Paris, 75006, France ;
19 Karolinska Institute, Department of Women's and Children's Health, Karolinska University Hospital, Stockholm, 17176, Sweden ;
20 INSERM U970, Paris Cardiovascular Research Center, Université Paris-Descartes, Sorbonne Paris Cité, Paris, 75015, France ;
21 Service d’immunologie biologique, Hôpital Européen Georges Pompidou, Paris, 75015 France ;
22 INSERM U1143, 75005 Paris, France ;
23 Institut Curie, PSL Research University, Endocytic Trafficking and Therapeutic Delivery group, Paris, 75248, France ;
24 CNRS UMR 3666, Paris, 75005, France ;
25 Service de microbiologie, GRCC, Villejuif, 94805, France ;
26 Department of Radiation Oncology, Weill Cornell Medicine, New York, NY, USA ;
27 Department of Immunology and Pathology, Monash University, Alfred Hospital Precinct, Melbourne, Prahran, Victoria 3181, Australia ;
28 Institute of Clinical Molecular Biology, Christian-Albrechts-University and University Hospital Schleswig-Holstein, Campus Kiel, 24105 Kiel, Germany ;
29 Aix Marseille Université, URMITE (Unité de Recherche sur les Maladies Infectieuses et Tropicales Emergentes), UMR 7278, INSERM 1095, IRD 198, Faculté de Médecine, Marseille 13005, France ;
30 CNR de la Résistance aux Antibiotiques, Laboratoire Associé Entérocoques, Caen, 14033, France ;
31 Institut Pasteur, Unit Biology and Genetics of the bacterial Cell Wall, Paris, 75015, France.
*All three authors equally contributed to this work
Mis à jour le 18/10/2016