L’équipe de Nicolas Reyes a réussi à stabiliser et à déterminer la première structure, à une résolution presque atomique, d’un transporteur de neurotransmetteur excitateur humain. Ce dernier est un élément clé de la machine synaptique dans le cerveau. Cette étude historique permet d’imaginer des solutions pharmacologiques pour moduler sélectivement ces transporteurs et contrôler la concentration d’une des molécules qu’ils transportent, le glutamate notamment. Or agir sur ces concentrations pourrait permettre de traiter certaines maladies neurodégénératives.
Les membres de la famille des transporteurs du glutamate, ou SLC1, sont des protéines transmembranaires qui transportent des neurotransmetteurs excitateurs dans le cerveau mais aussi des acides aminés dans les organes périphériques. La structure 3D d’un tel transporteur chez les procaryotes est connu depuis 2004, mais « personne n’avait réussi jusqu’à aujourd’hui à observer une protéine SLC1 humaine, car elle était trop instable en laboratoire », explique Nicolas Reyes, responsable du laboratoire Mécanismes moléculaires de transport membranaire*, dont l’équipe vient pourtant de réussir à stabiliser la protéine humaine.
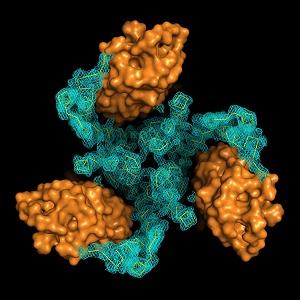 Structure en cristal du transporteur EAAT1 humain, thermostabilisé. EAAT1 fait partir de la famille des transporteurs du glutamate, dite famille SLC1. L'image montre le domaine d’échafaudage (maillage vert) et le domaine du transport (surface orange) qui déplace le neurotransmetteur glutamate à travers la membrane d’une façon semblable à celle d’un ascenseur. © Nico Reyes - Institut Pasteur
Structure en cristal du transporteur EAAT1 humain, thermostabilisé. EAAT1 fait partir de la famille des transporteurs du glutamate, dite famille SLC1. L'image montre le domaine d’échafaudage (maillage vert) et le domaine du transport (surface orange) qui déplace le neurotransmetteur glutamate à travers la membrane d’une façon semblable à celle d’un ascenseur. © Nico Reyes - Institut Pasteur
Une famille SLC1 impliquée en santé
« Le glutamate est le principal neurotransmetteur excitateur dans le cerveau, mais il est également très cytotoxique lorsque sa concentration extracellulaire augmente, un mécanisme pathologique associé à plusieurs maladies neurodégénératives », poursuit Nicolas Reyes. « Les transporteurs de glutamate pompent le neurotransmetteur à l’intérieur des cellules et sont des régulateurs-clés de sa concentration extracellulaire. Ainsi, ces transporteurs sont des cibles pharmaceutiques importantes pour réduire la concentration de glutamate dans des conditions pathologiques. » On observe une concentration extracellulaire élevée de glutamate, chez les patients atteints de la maladie d’Alzheimer, sans connaître la nature de cette corrélation. Toutefois, agir sur la concentration de glutamate pourrait être une piste pour traiter les patients.
Par ailleurs, dans les organes périphériques, la glutamine est un métabolite clé pour transformer les cellules en cellules malignes : là aussi, un transporteur de la famille SLC1 aide à maintenir les niveaux normaux de glutamine intracellulaire, utilisé comme un nutriment pour les cellules. Cependant, dans plusieurs formes de cancer de l’homme, comme celui du sein ou des poumons, le transporteur de glutamine SLC1 est produit en plus grande quantité pour fournir aux cellules cancéreuses les besoins « alimentaires » nécessaires à leur croissance explosive.
« Il serait vraiment puissant de pouvoir agir de manière pharmacologique sur le transport de la glutamine pour la thérapie contre le cancer, et notre travail ouvre la possibilité d’une conception rationnelle des médicaments des inhibiteurs du transport de la glutamine », déclare Nicolas Reyes. Une compréhension approfondie de la fonction des transporteurs SLC1 humains est donc essentielle, mais elle ne peut être réalisée sans observer leur structure 3D.
Une précision atomique sans précédent
L’équipe de Nicolas Reyes a déterminé les premières structures 3D d’un transporteur SLC1 humain, dévoilant un secret resté jusqu’ici inconnu des chercheurs depuis le clonage des transporteurs de neurotransmetteurs dans les années 90. « Nous pouvons voir ces protéines humaines importantes avec une précision presque atomique, souligne Nicolas Reyes. Nos structures nous aideront à comprendre les mécanismes de fonctionnement de cette famille de transporteur, et leur régulation par des lipides comme le cholestérol. » Désormais, il est possible d’imaginer des solutions pharmacologiques (des modulateurs allostériques) pour inhiber ou stimuler spécifiquement le transporteur SLC1 et moduler la concentration de neurotransmetteurs excitateurs ou d’acides aminés essentiels dans l’organisme. Ainsi, il serait possible de traiter certaines maladies neurodégénératives ou des cancers.
Structure 3D du transporteur Excitatory Amino Acid Transporter 1 (EAAT-1), de la famille des transporteurs du glutamate, dite famille SLC1. © Nico Reyes - Institut Pasteur
Ces travaux rappellent l’importance de la recherche fondamentale dans l’étude des mécanismes du vivant : « La fonction sans structure est un fantôme, et la structure sans fonction est un cadavre », conclut Nicolas Reyes en paraphrasant le Pr Stephen Wainwright (université Duke, Etats-Unis). « Nos observations à l'échelle atomique servent de base à la compréhension de la fonction réelle des protéines, mais nous remettons continuellement en jeu nos résultats structurels avec des tests fonctionnels. » Pourquoi certains transporteurs SLC1 sont-ils sélectifs pour le glutamate et d’autres pour la glutamine ? Quels sont les mécanismes qui inhibent ou potentialisent leur fonction de transport ? Ce sont quelques-unes des questions qui seront abordées dans les recherches à venir.
* Ce laboratoire est un « Groupe à cinq ans », c’est-à-dire une équipe de recherche destinée à de jeunes scientifiques à fort potentiel.
Source
Structure and allosteric inhibition mechanism of excitatory amino acid transporter 1, Nature, 19 avril 2017.
Juan C. Canul-Tec1,4♯, Reda Assal1,4♯, Erica Cirri1,4, Pierre Legrand2, Sébastien Brier3,4, Julia Chamot-Rooke3,4 & Nicolas Reyes1,4
1. Molecular Mechanisms of Membrane Transport Laboratory, Institut Pasteur, 25–28 rue du Docteur Roux, 75015 Paris, France
2. Synchrotron SOLEIL, L'Orme des Merisiers, 91192 Gif-sur-Yvette, France
3. Structural Mass Spectrometry and Proteomics Unit, Institut Pasteur, 25–28 rue du Docteur Roux, 75015 Paris, France
4. UMR 3528, CNRS, Institut Pasteur, 25–28 rue du Docteur Roux, 75015 Paris, France
♯These authors contributed equally to this work





