La maladie d’Alzheimer est un trouble neurodégénératif d’évolution progressive qui affecte principalement la mémoire, mais également d’autres fonctions cognitives liées à la connaissance et impliquant le langage, le raisonnement et la capacité d’apprentissage. Elle entraîne généralement chez les malades une perte d’autonomie. Elle est l’une des principales causes de handicap et de dépendance des personnes âgées. Aucun traitement curatif n’existe pour l’heure contre cette maladie, dont les mécanismes suscitent encore de nombreuses questions.
La maladie d’Alzheimer se caractérise par l’altération de la protéine tau qui stabilise la structure des neurones. Cette altération aboutit à la désorganisation de l’architecture neuronale, à la dégénérescence neurofibrillaire et à la mort des cellules nerveuses (consultez la fiche maladie de l’Institut Pasteur sur la maladie d’Alzheimer). Les protéines tau mal repliées s’agglomèrent et forment des enchevêtrements neurofibrillaires qui s’accumulent progressivement dans les neurones. Ces enchevêtrements peuvent induire des conformations anormales sur les protéines tau normales (c’est l’ « ensemencement »), à la manière de prions, déclenchant une réaction d’auto-amplification en cascade, et se propager de leur site de production initial à d’autres zones cérébrales, la maladie finissant par s’étendre à tout le cerveau. Le mécanisme sous-jacent de cette dissémination reste toutefois flou, car le destin et le comportement des agrégats formés de manière endogène n’ont pas été évalués.
Observation en temps réel de la protéine tau exprimée de manière endogène et de son agglomération
L’unité Trafic membranaire et pathogénèse de l’Institut Pasteur (Paris), en coopération avec GlaxoSmithKline et le Brain Institute du University of Texas Southwestern Medical Center, a étudié ce mécanisme. « Nous avons conçu un système de cellules neuronales rapporteuses permettant de capter en temps réel le passage de la protéine tau exprimée de manière endogène de l’état soluble à l’état d’agrégats, à l’ajout de fibrilles externes produites synthétiquement ou extraites du cerveau de patients atteints de la maladie d’Alzheimer. Nous avons montré que ce processus d’« ensemencement » n’était pas limitant et qu’il suivait la même cinétique quelle que soit l’origine des fibrilles », explique Chiara Zurzolo, responsable de l’unité Trafic membranaire et pathogénèse.
Les agrégats de tau endogènes bloquent leur propre dégradation, par autophagie, et se propagent via les TNT
« Par ailleurs, les agrégats formés de manière endogène sont considérés comme des cargaisons autophagiques (destinées à la destruction), mais ne sont pas transférés aux lysosomes à des fins de dégradation car le flux autophagique est partiellement bloqué. » Cette observation suggère que les agrégats de protéine tau formés de manière endogène bloquent leur propre dégradation par la voie autophagique. Enfin, le transfert intercellulaire des agrégats endogènes et exogènes repose sur le contact, ceux-ci transitant par des « tunneling nanotubes » (TNT) pour atteindre les cellules voisines.
Ces données étoffent les études antérieures menées par cette même équipe (unité Trafic membranaire et pathogénèse de l’Institut Pasteur) montrant que les TNT jouent un rôle dans la propagation intercellulaire des protéines amyloïdes pathogènes impliquées dans les maladies d’Alzheimer et de Parkinson, ce qui souligne l’incidence de voies similaires, qui pourraient être ciblées pour le développement de nouveaux traitements, dans la progression de différentes maladies neurodégénératives.
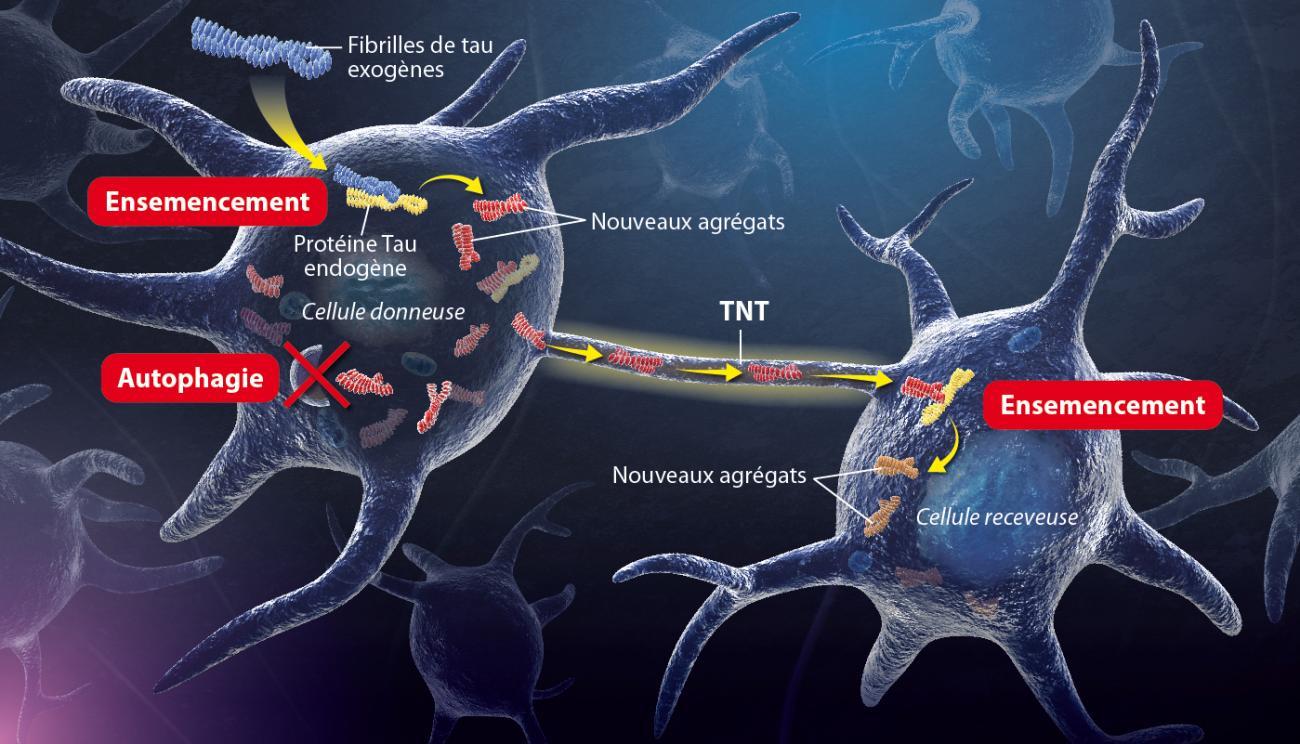
Illustration du mécanisme découvert par l’équipe de Chiara Zurzolo. Crédit: Institut Pasteur / P. Marseaud.
Fibrilles de tau exogènes: Les protéines tau exogènes agrégées pénètrent dans la cellule neuronale et s’y accumulent progressivement.
Ensemencement : Les fibrilles de tau exogènes induisent des conformations anormales sur des protéines tau normales, déclenchant une réaction d’auto-amplification en cascade.
Autophagie : Les agrégats de tau endogènes bloquent leur propre dégradation autophagique.
TNT: Les enchevêtrements neurofibrillaires se propagent aux cellules avoisinantes via les TNT et déclenchent le processus d’ensemencement dans les cellules naïves.
Ces travaux dressent un tableau plus documenté et complet sur la pathobiologie de la maladie d’Alzheimer et d’autres pathologies provoquées par les protéines tau. Ils jettent les bases de futures thérapies d’intervention ciblant spécifiquement le renforcement de l’élimination des fibrilles de tau et le blocage de leur propagation dans le cerveau.
Source
Fate and propagation of endogenously formed Tau aggregates in neuronal cells, EMBO Molecular Medicine, 12 novembre 2020.
Patricia Chastagner1, Frida Loria1, Jessica Y. Vargas1, Josh Tois1, Marc I. Diamond4, George Okafo2, Christel Brou1, Chiara Zurzolo1, 3.
1 Unité Trafic membranaire et pathogénèse, Institut Pasteur, Paris, France
2 GlaxoSmithKline, Gunnels Wood Road, Stevenage, R.-U., SG1 2NY
3 Correspondance : chiara.zurzolo@pasteur.fr
4 Center for Alzheimer’s and Neurodegenerative Diseases, Peter O’Donnell Jr. Brain Institute, University of Texas Southwestern Medical Center, Dallas, TX, États-Unis
Cette étude entre dans le cadre de l’axe scientifique prioritaire Maladies de la connectivité cérébrale et maladies neurodégénératives du plan stratégique 2019-2023 de l’Institut Pasteur.





