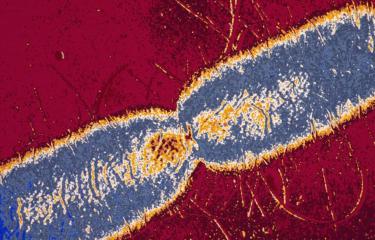
La résistance aux antibiotiques — ou antibiorésistance — est un enjeu de santé publique majeur. Conserver l’efficacité des antibiotiques contre les bactéries passe notamment par comprendre comment ces résistances fonctionnent et comment les bactéries deviennent résistantes. Explications.
Les antibiotiques sont des médicaments qui servent à lutter contre les infections dues à des bactéries. Ils ont sauvé et sauvent encore des millions de vies chaque année, mais leur efficacité est menacée car les bactéries peuvent s’adapter et résister au traitement. On parle de résistance aux antibiotiques ou aux antibactériens. « L’antibiorésistance désigne à la fois une dynamique qui existe depuis l’utilisation des antibiotiques, mais aussi l’ensemble des mécanismes que les bactéries utilisent pour résister à ces traitements », résume Didier Mazel responsable de l’unité Plasticité du génome bactérien à l’Institut Pasteur.
Comment les résistances fonctionnent ?
Plusieurs mécanismes de résistance existent et peuvent conduire à une même insensibilité au traitement. La plupart du temps, la bactérie va soit altérer l’antibiotique lui-même, soit la molécule cible avec laquelle celui-ci réagit normalement, ce qui dans les deux cas le rend inefficace. D’autres formes de résistance moins efficaces sont connues, comme la pompe d’efflux, qui permet d’expulser l’antibiotique en dehors de la bactérie.
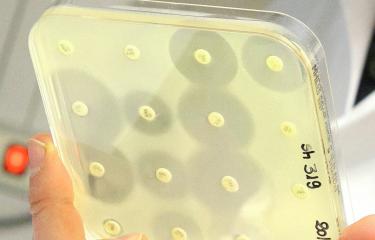
« La surveillance de l’antibiorésistance passe par la mesure de la fréquence des souches sensibles ou résistantes à un antibiotique, c’est-à-dire la proportion de bactéries devenues insensibles à ce médicament », poursuit Céline Loot, chercheuse dans l’unité de Didier Mazel.
Comment les bactéries deviennent résistantes ?
Quand elles sont confrontées à un antibiotique, les bactéries évoluent : les lignées résistantes se reproduisent mieux et finissent par devenir majoritaires.

Mais les nouvelles résistances se propagent bien plus vite par des mécanismes dits de « transferts horizontaux » : la résistance se transmet entre des organismes de lignées différentes, et non d’une bactérie à ses descendantes.
- La conjugaison, lorsque des bactéries se transmettent entre elles des petits morceaux de matériel génétique, appelés des plasmides, et qui peuvent porter des gènes qui fournissent des résistances. « Les plasmides peuvent se transmettre entre des genres bactériens très différents, ce qui en fait le mécanisme de transmission de résistances le plus important et celui que nous voudrions le plus contrôler », précise Céline Loot.
- La transformation naturelle, qui a lieu quand une bactérie intègre de l’ADN présent dans son environnement.
- La transduction, qui consiste en un transfert de matériel génétique entre une bactérie et un virus qui l’infecte. Ce mécanisme joue cependant un rôle mineur dans l’acquisition de résistance.
« Tout ce qui va stresser les bactéries va favoriser les transferts horizontaux, alerte Didier Mazel. C’est le cas des antibiotiques même à faible concentration, comme dans les eaux usées où l’on en trouve des traces. C’est d’autant plus le cas là où on concentre des bactéries, comme dans les biofilms, des communautés de cellules qui adhérent aux supports solides, et qui peuvent se former par exemple sur le matériel médical ».
La lutte contre l’antibiorésistance, un enjeu de santé publique
-
La prévention
Pour combattre l’antibiorésistance, « le plus efficace reste la prévention, souligne Céline Loot. Aujourd’hui, les foyers de la résistance sont en Asie du Sud-Est, où l’on voit une utilisation massive d’antibiotiques sans prescription médicale, qu’il faudrait limiter ».
-
Des alternatives aux antibiotiques actuels
« Nous sommes en quête de nouvelles molécules dont on aurait une utilisation prudente pour prévenir l’apparition de nouvelles résistances », développe la chercheuse. Les scientifiques développent aussi de nouveaux modes de traitements, « comme les bactériophages, ou rendre de nouveau la bactérie sensible à l’antibiotique. On souhaite aussi empêcher les transferts horizontaux pour limiter la dispersion des résistances. Au final, on devient très créatifs ! », décrit Didier Mazel.
La recherche fondamentale reste nécessaire, puisque c’est sur ces connaissances que s’appuie le développement de nouvelles approches thérapeutiques.
Ainsi , Didier Mazel et Céline Loot ont récemment publié une étude qui fait état de nombreuses séquences d’ADN pouvant se transmettre dans les génomes depuis les plasmides et qui n’étaient pas connues jusque-là. Ils montrent de plus que ces séquences peuvent s’intégrer définitivement dans le génome une fois rentrées dans la cellule, et jouent donc un rôle important dans l’évolution des bactéries. Contrôler ce mécanisme permettrait donc de contrôler la propagation des résistances.
Source :
Integron cassettes integrate into bacterial genomes via widespread non-classical attG sites, Nature Microbiology, 3 janvier 2024.
Céline Loot, Gael A. Millot, Egill Richard, Eloi Littner, Claire Vit, Frédéric Lemoine, Bertrand Néron, Jean Cury, Baptiste Darracq, Théophile Niault, Delphine Lapaillerie, Vincent Parissi, Eduardo P. C. Rocha & Didier Mazel
ESKAPEE : sept pathogènes à surveillerParmi les bactéries incriminées dans l’antibiorésistance, un groupe de sept pathogènes identifiés sous le terme de bactéries ESKAPEE constitue notamment une menace sérieuse. Ce sont les bactéries résistantes qui représentent le plus un problème de santé publique selon l’OMS, et sur lesquelles la recherche se focalise. Ces bactéries sont à l’origine de nombreuses infections nosocomiales : des infections pulmonaires, urinaires ou post-opératoires, mais aussi parfois des septicémies chez les patients immunodéprimés.
|

Résistance aux antibiotiques