Les différents variants du SARS-CoV-2 circulant actuellement sont certes responsables de moins de formes sévères dans la population générale vaccinée, mais les personnes immunodéprimées présentent un risque accru de développer des formes graves de la COVID-19. Les anticorps monoclonaux représentent actuellement la meilleure option thérapeutique pour traiter ces patients de manière préventive et curative. Des chercheurs de l’Institut Pasteur et de l’Inserm ont identifié chez des convalescents deux anticorps neutralisants puissants, actifs sur l’ensemble des variants préoccupants du SARS-CoV-2. Ces anticorps humains sont considérés comme des candidats prometteurs pour le développement d’immunothérapies pour la prévention des formes graves et/ou le traitement de la COVID-19. Ces résultats sont publiés dans The Journal of Experimental Medicine, le 15 juin 2022.
Les anticorps et les lymphocytes B mémoires dirigés contre la protéine de spicule[1] du SARS-CoV-2, ou protéine S, contribuent à la protection et l’immunité à long terme contre les formes sévères de la COVID-19. Celles-ci peuvent également être prévenues par des immunothérapies à base d’anticorps neutralisants chez les sujets ne répondant pas à la vaccination, comme par exemple les immunodéprimés qui représentent environ 230 000 personnes en France. Les avantages thérapeutiques des anticorps dits « monoclonaux »[2] anti-SARS-CoV-2 ont déjà étés démontrés dans des essais cliniques pour traiter les malades atteints de COVID-19 et prévenir l’évolution vers des formes graves.
Dans cette étude réalisée par les scientifiques du laboratoire d’Immunologie humorale à l’Institut Pasteur (unité mixte Inserm) dirigé par le Dr Hugo Mouquet et en collaboration avec de nombreuses équipes de l’Institut Pasteur et de l’Inserm, l’immunité contre le SARS-CoV-2 chez des convalescents COVID-19 a été explorée par des analyses exhaustives des anticorps ciblant la protéine S du SARS-CoV-2 et ceci, au niveau sérologique (anticorps circulants dans le sang), cellulaire (les lymphocytes B qui produisent les anticorps), et moléculaire (étude d’anticorps monoclonaux). En particulier, la caractérisation détaillée d'une centaine d'anticorps monoclonaux humains spécifiques de la protéine S du SARS-CoV-2, clonés à partir des cellules B mémoires isolées de sujets convalescents, a permis de révéler la diversité notamment de leurs fonctions antivirales, telles que la neutralisation ou l’élimination des cellules infectées.
« Parmi les anticorps neutralisants puissants identifiés, deux anticorps Cv2.1169 et Cv2.3194, sont à large spectre, c’est-à-dire actifs sur l’ensemble des variants préoccupants du SARS-CoV-2 : Alpha, Beta, Gamma, Delta, Omicron BA.1 et BA.2. L’anticorps monoclonal Cv2.1169, testé dans des modèles animaux de l’infection SARS-CoV-2, s’est révélé posséder une activité prophylactique (prévention) et thérapeutique in vivo », commente Hugo Mouquet, responsable du laboratoire d’Immunologie humorale à l’Institut Pasteur (unité mixte Inserm).
L’anticorps Cv2.1169 ayant été isolé à partir d'un lymphocyte B issu de tissus muqueux, la présence de ce type d’anticorps dans les muqueuses d’individus convalescents pourrait donc participer à la protection contre l'infection par des variants du SARS-CoV-2.
« Ces anticorps monoclonaux humains neutralisants puissants et à large spectre représentent des candidats prometteurs pour le développement d’immunothérapies chez l’homme ayant pour but la prévention et/ou le traitement du COVID-19 », ajoute Hugo Mouquet.
Dans ce contexte, une demande internationale de brevet a été déposée par l’Institut Pasteur pour protéger les anticorps neutralisants identifiés dans cette étude [“Human neutralizing monoclonal antibodies against SARS-CoV-2 and their use thereof” (PCT/EP2022/058777)]. Cette demande de brevet fait l’objet d’une licence exclusive et mondiale avec SpikImm, une société de biotechnologies créée par Truffle Capital et l’Institut Pasteur, qui développe ces anticorps, comme des anticorps faciles à administrer (voie intramusculaire) et à action prolongée pour la prévention de la COVID-19 (prophylaxie pré-exposition) chez les patients immunodéprimés souvent faiblement ou non répondeurs après un schéma vaccinal complet. SpikImm prévoit d'initier des essais cliniques dès juillet 2022. Le Comité ad-hoc de pilotage national des essais thérapeutiques et autres recherches (CAPNET) a récemment attribué le label de « Priorité nationale de recherche » pour cette étude de phase 1.
[1] Ou protéine Spike
[2] Les anticorps monoclonaux sont des anticorps fabriqués par des cellules en culture pour traiter des maladies spécifiques.
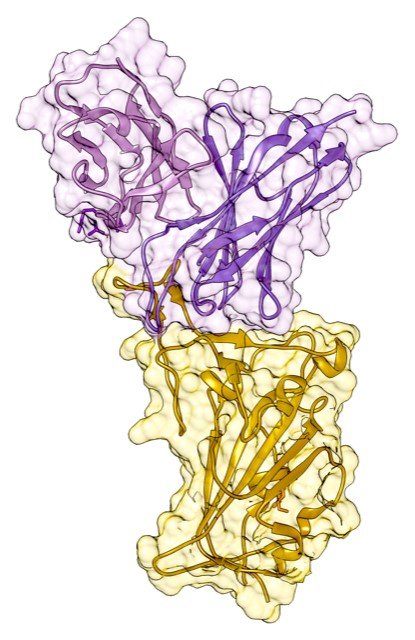
Structure des domaines variables de l’anticorps Cv2.1169 (Violet) en complexe avec le domaine de la protéine S impliqué dans la fixation au récepteur du SARS-CoV-2 (RBD, receptor binding domain; jaune), obtenu par cristallographie des rayons X dans le laboratoire de Virologie Structurale (Institut Pasteur). © Hugo Mouquet, Institut Pasteur
Source :
Potent Human Broadly SARS-CoV-2 Neutralizing IgA and IgG Antibodies Effective Against Omicron BA.1 and BA.2, Journal of Expertimental Medicine, 15 juin 2022
Cyril Planchais1,2, Ignacio Fernández3,4, Timothée Bruel4,5,18, Guilherme Dias de Melo6,18, Matthieu Prot7,18, Maxime Beretta1,2, Pablo Guardado-Calvo3,4, Jérémy Dufloo4,5, Luis M. Molinos-Albert1,2, Marija Backovic3,4, Jeanne Chiaravalli8, Emilie Giraud8, Benjamin Vesin9,10, Laurine Conquet11, Ludivine Grzelak4,5, Delphine Planas4,5, Isabelle Staropoli4,5, Florence Guivel-Benhassine4,5, Thierry Hieu12, Mikaël Boullé8, Minerva Cervantes-Gonzalez13, Marie-Noëlle Ungeheuer14, Pierre Charneau9,10, Sylvie van der Werf4,15,16, Fabrice Agou8, French COVID Cohort Study Group#, CORSER Study Group#, Jordan D. Dimitrov17, Etienne Simon-Lorière7,19, Hervé Bourhy6,19, Xavier Montagutelli11,19, Félix A. Rey3,4,19, Olivier Schwartz4,5,19, Hugo Mouquet1,2,20
1Institut Pasteur, Université Paris Cité, Laboratory of Humoral Immunology, F-75015 Paris, France
2INSERM U1222, F-75015 Paris, France
3Institut Pasteur, Université Paris Cité, Structural Virology Unit, F-75015 Paris, France
4CNRS UMR3569, F-75015 Paris, France
5Institut Pasteur, Université Paris Cité, Virus & Immunity Unit, F-75015 Paris, France
6Institut Pasteur, Université Paris Cité, Lyssavirus Epidemiology and Neuropathology Unit, F-75015 Paris, France
7Institut Pasteur, Université Paris Cité, G5 Evolutionary Genomics of RNA Viruses, F-75015 Paris, France
8Institut Pasteur, Université Paris Cité, Chemogenomic and Biological Screening Core Facility, C2RT, F-75015 Paris, France
9Pasteur-TheraVectys, F-75015 Paris, France
10Institut Pasteur, Université Paris Cité, Molecular Virology & Vaccinology Unit, F-75015 Paris, France
11Institut Pasteur, Université Paris Cité, Mouse Genetics Laboratory, F-75015 Paris, France
12 Institut Pasteur, Université Paris Cité, Functional Genetics of Infectious Diseases Unit, F-75015 Paris, France
13Department of Epidemiology, Biostatistics and Clinical Research, Assistance Publique-Hôpitaux de Paris, Bichat Claude Bernard University Hospital, INSERM CIC-EC 1425, Paris, France
14Institut Pasteur, Université Paris Cité, Investigation Clinique et Accès aux Ressources Biologiques (ICAReB), Center for Translational Research, F-75015 Paris, France
15Institut Pasteur, Université Paris Cité, Molecular Genetics of RNA Viruses, F-75015 Paris, France
16Université de Paris, Paris, France
17Centre de Recherche des Cordeliers, INSERM, Sorbonne Université, Université de Paris, 75006 Paris, France
18Equal contribution.
19These senior authors contributed equally.
20Lead contact.