Une lutte historique contre les maladies infectieuses émergentes

L’émergence infectieuse est le résultat d’une rencontre entre un microbe et un animal. L’espèce humaine est l’espèce animale la plus parasitée. De la peste en Asie en 1894 à la Covid-19 aujourd’hui, les chercheuses et chercheurs de l’Institut Pasteur ont toujours porté les savoirs et les savoir-faire au service de la connaissance et des populations.
SOMMAIRE
Avant-propos - Les émergences, un fait fatal et imprévisible
Définition - Qu’est qu’une maladie infectieuse émergente ?
Explication - Bienvenue dans l’ère des émergences
Portrait - Celle qui traque le virus VIH depuis plus de 30 ans
Retour - La pandémie covid-19, en trois actes
Fiche d'identité - Shigellose, profil d’une émergence
Conclusion - L'unité de la vie - L’homme, l’environnement, l’animal, les maladies / par Erik Orsenna
Les émergences, un fait fatal et imprévisible
Entre 1918 et 1919, la « grippe espagnole » touche en quelques mois un tiers de la population mondiale. L’Espagne fut le premier pays à révéler la maladie mais l’épidémie débuta probablement en Asie avant de passer aux États-Unis, pour arriver plus virulente et mortelle en Europe avec les soldats américains. Le risque pandémique est aujourd’hui plus élevé qu’en 1918, du fait de temps de transport très courts. Les virus font le tour du monde en 1 jour, contre 1 an au XIXe siècle. Si la recherche et l’intervention sanitaire sont parfois ralenties par les règlementations, les systèmes d’alerte se sont améliorés et la connaissance de la biologie des virus a progressé. De plus, le règlement sanitaire international de 2005 a permis l’augmentation des capacités d’analyse des laboratoires.
On sait aussi que la phase la plus importante pour lutter contre les épidémies est celle de l’introduction (ou spillover/débordement, voir plus loin). En 2003, l’identification rapide du virus du syndrome respiratoire aigu sévère (SRAS) a permis des confinements efficaces car les patients n’étaient pas contagieux avant le début des symptômes, qui ont conduit à l’extinction du virus. En 2020 à l’inverse, la Covid-19 a vite essaimé après sa phase d’introduction. L’OMS a alors déclaré la pandémie, la communauté scientifique s’est immédiatement mobilisée et la vaccination a contribué à limiter la gravité et la propagation de la maladie, en plus des mesures de confinement.
Pourquoi un tel risque encore aujourd’hui ? En analysant les déterminants majeurs des émergences virale depuis 1940, le changement de l’usage des terres semble prépondérant dans 1 cas sur 4. Si le climat semble moins en cause sauf pour les arbovirus, ce constat pourrait évoluer avec le réchauffement climatique.
Qui sont les coupables ? Les émergences sont imprévisibles, par définition. Mais ce sont surtout les virus à ARN, souvent respiratoires et facilement transmissibles (virus grippaux, coronavirus…) qui présentent un risque important. C’est cependant un rétrovirus qui a émergé dans les années 80, provoquant le sida. Retenons donc que les émergences sont un « fait fatal », comme le disait le scientifique Charles Nicolle. Mais ne soyons pas fatalistes : les progrès scientifiques restent toujours source d’espoir.
Avec Jean-Claude Manuguerra, responsable de l’unité Environnement et risques infectieux, de la Cellule d’intervention biologique d’urgence, du CNR Hantavirus, et coresponsable d’un centre collaborateur de l’OIE - Organisation mondiale de la santé animale – consacré aux pathogènes animaux émergents chez l’Homme.
Qu’est qu’une maladie infectieuse émergente ?

émergence, n.f.
Apparition soudaine dans une suite d’évènements, d’idées. Par extension, apparition d’un organe biologique nouveau ou de propriétés nouvelles. Synonymes : survenue, apparition, jaillissement (Le Robert).
L’émergence préexiste à sa découverte et n’apparaît que pour celui qui la rencontre.
En santé humaine, l’émergence suppose une révélation. « Une maladie émergente est l’irruption au sein d’une population humaine d’un agent pathogène nouveau, à partir d’un réservoir animal ou environnemental, ou à la suite d’une modification génétique d’un agent pathogène existant », résume Caroline Demangel. « Il peut également s’agir d’une maladie connue qui réapparaît en s’étendant géographiquement ou en devenant plus transmissible ou plus sévère : on parle alors de maladie ré-émergente ». Les maladies infectieuses émergentes et ré-émergentes sont des épiphénomènes de l’existence des êtres humains, de leurs interactions entre eux et avec la nature. À mesure que les sociétés humaines croissent en taille et que leurs habitats grignotent sur les écosystèmes naturels, nous créons une variété infinie d’opportunités pour que des agents infectieux se transmettent à l’être humain et que des nouvelles maladies émergent. L’acception de l’émergence suppose la surprise, le changement soudain par rapport à ce qui est connu. Mais alors, comment anticiper ce que l’on ne connaît pas encore ? C’est le fondement-même de la recherche scientifique…
Avec Caroline Demangel, responsable de l’unité Immunobiologie et thérapie et co-responsable de l’axe Maladies infectieuses émergentes (axe n°1 du Plan stratégique de l’Institut Pasteur 2019-2023).
Bienvenue dans l’ère des émergences
En 1995, Stephen Morse, professeur d’épidémiologie à l’Université de Columbia, proposait de définir comme émergentes des « infections nouvellement apparues dans la population ou des maladies ayant déjà existé mais présentant soudain un profil d’accroissement rapide d’incidence ou d’extension géographique. » Sa théorisation arrivait à la fin d’un siècle qui avait vu coexister des visions optimistes d’éradication des maladies infectieuses, encouragées par des succès comme celui de l’éradication de la variole, déclarée par l’Organisation mondiale de la santé (OMS) en 1979, mais aussi par une accélération des émergences ou réémergences et de leur ampleur, à l’image d’Ebola ou du sida. Si l’amélioration de la connaissance autour de ces phénomènes et de la capacité de réponse ne fait aucun doute, l’explosion des facteurs leur permettant d’apparaître fait caractériser notre époque comme celle de « l’ère des émergences ». Pas moins de 335 maladies émergentes ont en effet été détectées entre 1940 et 2004, n’épargnant aucun continent. Mais pourquoi ?
 Le 15 juin 1894, Alexandre Yersin débarque à Hong Kong, avec un microscope et un autoclave, alors qu’une épidémie décime la population. Dans sa paillotte (voir photo), à partir d’un bubon prélevé sur un patient décédé, il identifie le bacille de la peste plus tard nommé Yersinia pestis. De nombreux pasteuriens étudient ainsi depuis plus de 130 ans des pathologies endémiques et épidémiques. |
Anthropocène, la 4e rupture
L’émergence infectieuse est le résultat d’une rencontre pour laquelle l’espèce humaine est la championne toutes catégories : on recensait au début du XXIe siècle 1 400 espèces de microbes et parasites (Cleveland et coll. 2001) pouvant toucher Homo sapiens, ce qui en fait l’espèce animale la plus parasitée.
La première rupture se produit 75 000 ans avant notre ère : le Néolithique marque le début de l’organisation socioéconomique des populations. Les chasseurs-cueilleurs commencent à se regrouper en petites communautés et à se sédentariser. Agriculture, domestication d’espèces animales, interactions avec la faune sauvage et proximité des individus créent les premières conditions favorables à des sauts d’espèce. Plus les peuplements se généralisent, plus l’on multiplie les possibilités de transmission, et l’on commence à voir apparaître des maladies comme la coqueluche, la tuberculose ou la rougeole.
L’urbanisation et les échanges commerciaux favorisés par l’essor des grands empires romains et chinois vont marquer la seconde rupture, autour du 1er siècle après JC. L’établissement de liens économiques entre continent européen et asiatique précipite l’unification microbienne de l’Eurasie. Les brassages au rythme des caravanes des routes de la soie vont permettre les échanges et la diffusion de biens, d’idées et de pratiques, mais aussi de maladies comme la peste, la variole et la lèpre.
Au tournant du XVIe siècle s’initie la troisième rupture, poussée par les vents des grandes conquêtes maritimes et l’expansion des empires coloniaux. L’unification microbienne devient transcontinentale, entre l’ancien et les nouveaux mondes. Avec les conquêtes coloniales puis le commerce triangulaire, des agents infectieux comme la variole, la rougeole, la syphilis et le paludisme se retrouveront des deux côtés de l’Atlantique.
L’explosion des échanges et la globalisation qui forment l’histoire du XXe siècle vont achever d’entériner la 4e rupture, celle de l’Anthropocène : l’ère où les êtres humains constituent la principale force de changement sur les écosystèmes. Un virus peut aujourd’hui changer de continent en une nuit de vol international…
Mais si l’on peut lire l’histoire de l’Humanité sous le prisme des échanges, et donc comprendre comment leur intensification contribue à l’émergence de maladies infectieuses, il faut aussi regarder quels facteurs favorisent l’apparition des agents pathogènes dans la sphère humaine.
Comment et pourquoi les maladies infectieuses émergent-elles ?
Les mécanismes de l’émergence infectieuses sont multiples, mais on peut en résumer l’évolution en trois stades.
Stade 1 : le débordement
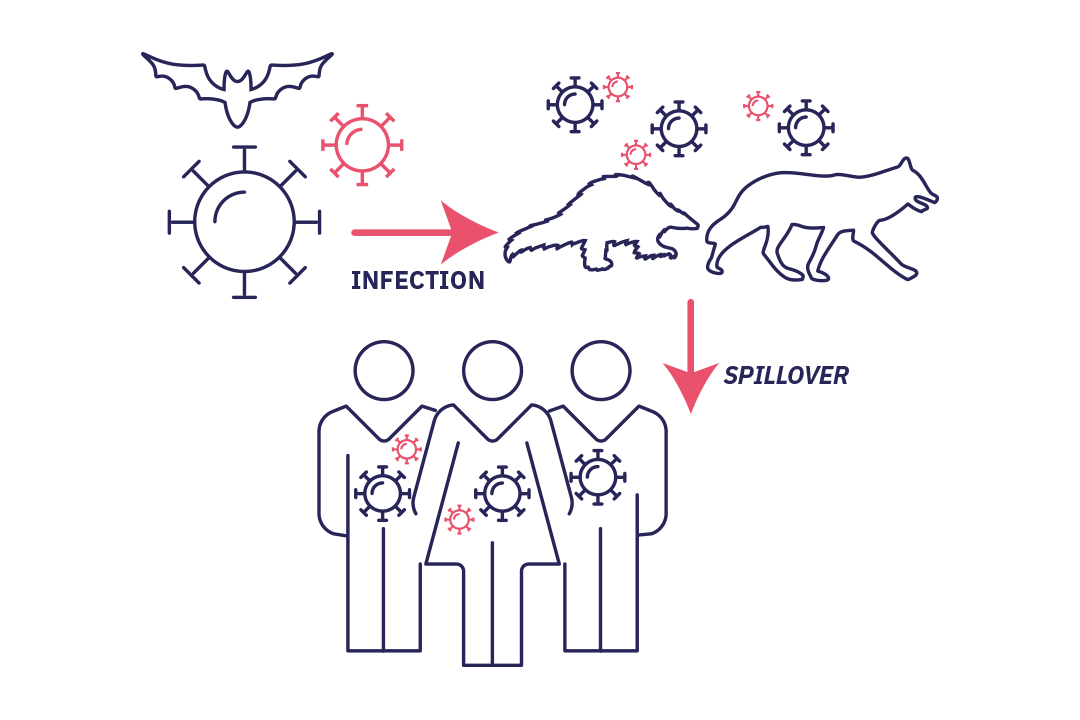
Stade 1 : Débordement, sans transmission secondaire : épisode (accidentel) d’infection d’un nouvel hôte, le virus ne trouve pas chez ce nouvel hôte humain la capacité de se développer.
Le point d’origine est un épisode accidentel d’infection d’un hôte par un microorganisme. L’agent biologique prolifère dans cet hôte, souvent un animal, ou bien dans ses sécrétions (salive, urine…), ses déjections ou l’environnement souillé. Puis, un être humain entre en contact avec l’animal, soit directement, soit par le biais d’un deuxième animal servant de vecteur au pathogène. Et il est contaminé. C’est ce qu’on appelle le spillover, ou débordement : un virus « déborde » de son habitat habituel pour passer chez l’homme. Le plus souvent, le virus ne trouve pas chez son nouvel hôte humain la capacité de se développer. L’histoire s’arrête là.
Stade 2 : le saut d’espèce
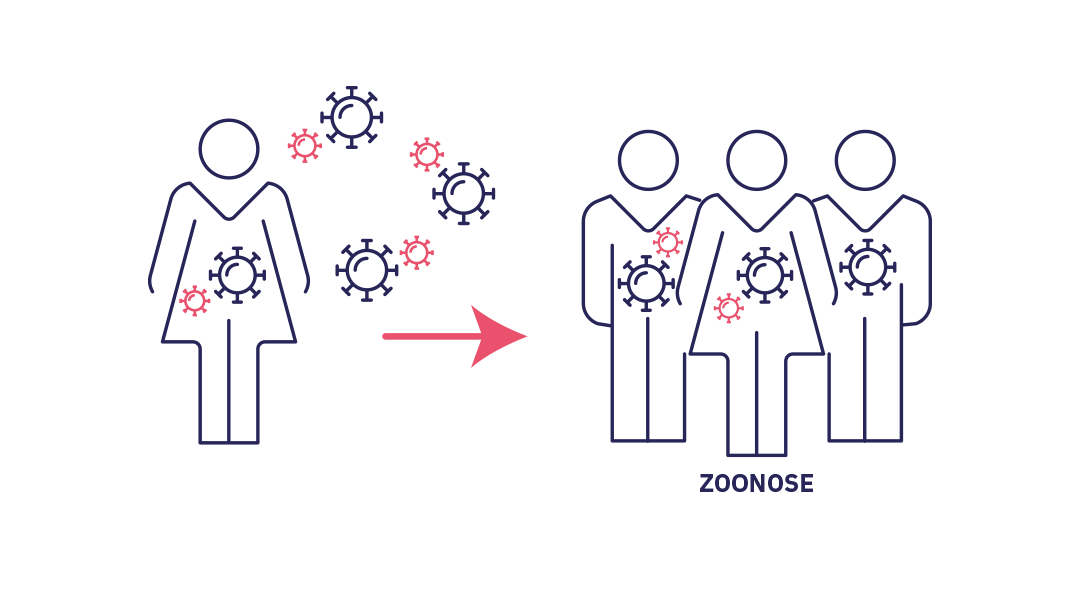
Stade 2 : Le pathogène s’installe au sein de l’espèce humaine (saut d’espèce). Débordements successifs donnant lieu à une chaîne limitée de transmission dans la population touchée. Si l’épidémie s’éteint spontanément, on parle d’outbreak (flambée).
Dans certains cas rares, le débordement, ou des débordements successifs, va donner lieu à une chaîne locale de transmission. Progressivement, le microorganisme va trouver les moyens de s’adapter et de se développer dans l’espèce humaine. C’est le phénomène du saut d’espèce, c’est-à-dire une véritable installation du pathogène au sein d’une nouvelle espèce. Cette transmission d’origine animale est ce que l’on appelle une zoonose, à l’origine de 60% des maladies humaines selon l’OMS. L’avenir de l’infection se joue alors autour de la transmissibilité au sein de cette nouvelle population.
Stade 3 : la circulation

Stade 3 : L’épidémie s’installe, voire se transforme en pandémie du fait d’une transmission très efficace au sein de la nouvelle population hôte.
La transmission se généralise et l’épidémie s’installe du fait notamment de la capacité du pathogène à vaincre les résistances grâce à des mutations secondaires. L’expansion géographique et le taux de reproduction détermineront le passage en statut pandémique.
La barrière du saut d’espèce est normalement particulièrement robuste : le phénomène, bien que critique, est rare et complexe mais on peut dégager un certain nombre de facteurs qui encouragent sa survenue.
Des facteurs biologiques d’abord : les microbes s’adaptent, tentant de déjouer les tactiques mises en place par les systèmes immunitaires. Les hôtes sont, eux, plus ou moins sensibles à l’agent infectieux, en fonction de facteurs génétiques, environnementaux ou sociaux. Et il ne faut pas sous-estimer la capacité de certains animaux vecteurs, arthropodes ou moustiques par exemple, à être particulièrement aptes à héberger puis transmettre des virus à l’homme en servant de passerelle entre espèces, comme on l’a vu avec Zika en 2016 en Amérique.
Des facteurs humains, socioéconomiques ou politiques ensuite. L’explosion des voyages internationaux et des échanges commerciaux, l’occupation des terres et l’altération des écosystèmes, les inégalités sociales, notamment en matière d’éducation, les contextes de guerre, d’insécurité alimentaire, de mauvaise gouvernance, sont autant de facteurs qui offrent un terrain favorable à ces émergences et conditionnent leur transmissibilité ou leur échec. Les cas récents du virus Nipah (en 1999 en Malaisie) ou du SARS-CoV-1 (en 2002-2003 en Chine et en Asie du Sud-Est) montrent bien comment la combinaison de facteurs environnementaux (déforestation, destruction des habitats d’animaux réservoirs entrant en contact avec des animaux vecteurs) et sociaux (consommation d’animaux vecteurs) créent les conditions d’un saut d’espèce.
Des facteurs physiques enfin, liés à la survenue toujours plus importante de phénomènes naturels extrêmes (inondations, séismes, tempêtes, feux) qui modifient l’équilibre des écosystèmes et bousculent les interactions entre espèces.
Il serait réducteur de poser l’action humaine sur son environnement comme seul point d’origine à une émergence. Pour autant, il est évident que les changements opérés par l’homme sur les habitats naturels augmentent les risques de rencontre entre des animaux vecteurs, des réservoirs d’agents infectieux et l’homme. Sans compter les facteurs sociaux, dont l’explosion des échanges internationaux, qui créent des conditions parfaites à l’expansion mondiale d’un phénomène local.
Peut-on anticiper la prochaine émergence ?
On comprend bien l’importance de détecter une potentielle émergence au stade du débordement. L’anticipation est aussi complexe que l’imbrication des facteurs mais elle repose sur trois principes simples : surveiller, évaluer, alerter. La coopération scientifique est cruciale dans ce domaine encore plus que dans d’autres, de même que la capacité à modéliser, séquencer, diagnostiquer. Ce sont des enjeux pluridisciplinaires qui nécessitent des approches intégrées. La pandémie de SARS-CoV-2 a mis nos systèmes à rude épreuve mais ils ont prouvé leur efficacité : séquençage du virus en moins de 3 semaines, outils de diagnostic déployés en moins d’un mois, vaccin en un an. Ces exploits techniques et technologiques ne doivent pas faire oublier le risque et les moyens de s’en prémunir. Il faut notamment réfléchir aux facteurs qui favorisent ces émergences, en interrogeant nos interactions avec les écosystèmes car c’est là que réside le « génie des maladies infectieuses » dont parlait Charles Nicolle, médecin et microbiologiste français, formé à l’Institut Pasteur, prix Nobel de médecine en 1928. S’il est difficile d’anticiper en l’état actuel de la science, il est vital de détecter et rapporter en urgence tout événement d’émergence afin de tuer l’épidémie dans l’oeuf. Surveiller l’environnement et les populations animales et humaines s’inscrit dans le concept One Health : « une santé unique pour l’homme et l’animal dans un environnement partagé. »
 Contact entre une cellule dendritique et un lymphocyte. |
Avec Philippe Sansonetti, microbiologiste, professeur au Collège de France, titulaire de la chaire Microbiologie et maladies infectieuses, professeur à l’Institut Pasteur.
« Il y aura donc des maladies nouvelles. C’est un fait fatal (…). »


Celle qui traque le VIH depuis plus de trente ans
Pour Michaela Müller-Trutwin, la rencontre avec le virus auquel elle dédiera sa carrière est le fruit d’une quête d’utilité. Des bancs de l’Université de Bonn aux paillasses « Pasteur », à Bangui puis à Paris, elle étudie le VIH (virus de l’immunodéficience humaine, responsable du sida) depuis plus de trente ans, et a toujours fait le choix d’aller là où le besoin de recherche est le plus grand.
« Tout est parti d’un engagement personnel », raconte l’intéressée. Pendant ses études de biologie en Allemagne, elle choisit de s’investir dans les pays du Sud, là où les enjeux sont les plus critiques, et pose ses valises à l’Institut Pasteur de Bangui, en République Centrafricaine. Nous sommes au début des années 90, et l’épidémie liée au virus du VIH fait des ravages en Afrique. Les variants du VIH qui y circulent semblent très différents par rapport à ceux circulant aux États-Unis et en Europe. Michaela se met donc au travail pour tenter de lever le voile sur les variants circulant en Afrique centrale. Ce n’est pas une mince affaire : « Les tests PCR disponibles étaient calibrés pour les variants américains et européens et se révélaient des fois inefficaces », explique-t-elle. Il lui faudra par ailleurs un an pour mettre en place les premiers tests de PCR pour des virus apparentés au VIH présents chez des singes vivant en République Centrafricaine. Ses travaux, enrichis par une approche en bio-informatique, vont être déterminants pour débusquer les variants circulant plus efficacement, informations qui vont nourrir les études vaccinales. Elle travaille en parallèle sur l’origine-même du virus et, en collaboration avec le Centre Pasteur au Cameroun et une équipe de l’ap-HP, caractérise le premier SIV proche du VIH Type-1 (équivalent du VIH chez les primates, NDLR) chez les chimpanzés du sud-est du Cameroun.
Après avoir rejoint à Paris le laboratoire de l’Institut Pasteur dirigé par Françoise Barré-Sinoussi, qui partagera avec Luc Montagnier en 2008 le Prix Nobel de médecine pour leur co-découverte du VIH, elle y poursuit ses travaux en collaboration étroite avec le Pasteur Network (Bangui, Dakar, Cameroun) et le Centre International de Recherche Médicale au Gabon, en s’attachant au transfert de savoir-faire et de compétences.
Au début des années 2000, en étudiant de très près les singes verts d’Afrique infectés par le SIV, elle s’intéresse au fait qu’ils ne développent pas la maladie et recherche le mécanisme de protection naturel contre le sida. « Nous avons découvert qu’ils peuvent contrôler l’inflammation résultant de l’infection et avons contribué à déterminer que l’inflammation se trouve être à la source de l’immunodéficience et du développement de la maladie du sida chez l’Homme ». Cette découverte sur une résolution rapide de l’inflammation contribuera à mettre l’accent sur l’importance de réduire au maximum le délai entre l’infection et la mise sous trithérapie.
Mais Michaela ne s’arrête pas là. Son modèle du singe vert va continuer à nourrir ses recherches : elle y découvre en 2021 le rôle inédit des cellules tueuses naturelles (voir les avancées du département de virologie) dans le contrôle de la réplication virale et la réduction des réservoirs viraux cachés dans nos ganglions lymphatiques. Cette avancée remarquable ouvre la voie à de nouvelles pistes dans la recherche d’une thérapie de guérison du VIH. Une chose est sûre, même si Michaela n’en a pas fini avec le VIH, l’utilité de ses travaux n’est plus à prouver.
La pandémie covid-19, en trois actes
Prologue
Beaucoup a été dit et écrit sur la pandémie de Covid-19. Le recul nécessaire aux enseignements scientifiques n’est pas encore tout à fait à notre portée, mais ce n’est pas la première pandémie auquel le monde moderne fait face. De nombreux experts avaient anticipé que le risque d’une émergence à potentiel pandémique viendrait d’un virus respiratoire, par essence très transmissible. Toutefois, elle a pris de vitesse des systèmes d’alerte et de réponse établis, et révélé l’intérêt d’avoir une communauté scientifique internationale très connectée. Retour en trois actes sur le phénomène pandémique.
Acte 1 : identifier la menace
 Échantillon de cellules de bronche élevées en culture et colorisées, en bleu. En orange, le coronavirus SARS-CoV-2. |
Certitude. Les travaux des équipes du Pasteur Network, à Paris et au Laos, publiés début 2022 dans la revue Nature, ont permis d’identifier, chez des chauves-souris au Laos, un coronavirus dont la zone d’attache au récepteur humain ACE2 est quasi-identique à celle du SARS-CoV-2. La chauve-souris serait le réservoir du virus mais l’hôte intermédiaire entre la chauve-souris et l’homme reste inconnu, même si le pangolin a un temps été suspecté. Si la détermination de l’origine de l’émergence importe pour prévenir la ré-introduction du virus en population humaine, l’identification de l’agent infectieux reste l’urgence de santé publique.
Aujourd’hui, le « séquençage à haut débit » permet de reconstituer le génome d’un agent pathogène inconnu en 2 à 4 semaines. Pour le SARS-CoV-2, ce séquençage complet est publié le 12 janvier 2020, à peine douze jours après l’annonce des premiers cas, preuve de la mobilisation intense des scientifiques chinois.
Une fois la séquence du pathogène caractérisé, il est possible de mettre au point un test diagnostique. Celui-ci permet de repérer les premiers foyers d’une épidémie, les cas importés, et de trier les patients suspects. C’est le travail engagé par l’Institut Pasteur à Paris et son CNR Virus des infections respiratoires et qui aboutira, le 31 janvier 2020, aux premiers tests basés sur la technique de RT-qPCR. Ils sont immédiatement communiqués en milieu hospitalier.
Les premiers cas sont arrivés sur le territoire français à peine quelques jours auparavant, le 24 janvier 2020, et le virus a été isolé à l’Institut Pasteur le 27 janvier. Puis l’épidémie va s’accélérer et les moyens de suivre son évolution se mettent en mouvement.
Acte 2 : comprendre et répondre au fil de l’épidémie
L’OMS déclare la pandémie le 11 mars 2020. Passer du stade épidémique au stade pandémique repose sur la diffusion des cas et leur multiplication sur un plan géographique. En clair : le virus circule sur tous les continents et rien ne semble arrêter sa progression.
Une task force est à l’oeuvre dès le 22 janvier à l’Institut Pasteur, avec des points hebdomadaires permettant de piloter une recherche globale et pluridisciplinaire. Les 12 février et 7 mars 2020 sont lancés deux appels à projets de recherche au sein du Pasteur Network qui regroupe tous les membres du réseau international.
Toutes les expertises sont mobilisées autour de la pandémie. Chaque département va, à sa manière et dans son périmètre, se saisir de l’enjeu pour améliorer la compréhension de l’épidémie qui se déroule sous nos yeux. C’est une mobilisation colossale et une collaboration qui fédère la communauté scientifique mondiale dans un élan rarement vu auparavant.
À Paris, des travaux s’enclenchent sur des études épidémiologiques sur les lieux de transmission du SARS-CoV-2, des modèles mathématiques sur la dynamique de l’épidémie, le développement d’approches diagnostiques, thérapeutiques (en 2021, la thérapie par anticorps monoclonaux) ou vaccinales (une piste de vaccin intranasal développée avec Theravectys qui a progressé en 2021, avec deux publications montrant son efficacité chez l’animal qui devrait entrer en phase d’essai clinique d’ici à la fin 2022) ; et deux autres pistes explorées en 2020 : un candidat-vaccin basé sur un vecteur rougeole, qui s’est révélé insuffisamment immunogène pour aller plus loin, et un vaccin ADN – cf. rapport annuel 2020 –). Les connaissances scientifiques ont permis de suivre l’épidémie et d’éclairer les pouvoirs publics dans leurs réponses de santé publique. Près d’une centaine de projets de recherche seront ainsi lancés à l’Institut Pasteur dans les premiers mois de l’épidémie pour tenter de comprendre et répondre.
Acte 3 : retrouver le temps long de la recherche scientifique
Si une pandémie finit toujours par s’arrêter, son dénouement est difficile à écrire à l’avance. Comment et quand en sort-on ? Ces questions reviennent à chaque nouvelle émergence. Peut-être parce que plusieurs temporalités coexistent. Il y a le temps court presqu’immédiat de la santé publique qui débouche sur des outils essentiels à la prise en charge des patients et à la réponse à l’épidémie. Et le temps long de la recherche scientifique pour comprendre avec précision la biologie du virus et l’émergence dans une approche pluridisciplinaire. En 2021, l’Institut Pasteur a lancé des projets fédérateurs, engageant chacun au moins 4 équipes pasteuriennes, pour dénouer les grandes questions scientifiques derrière cette pandémie. Il faudra quelques années pour les mener à bien mais leurs résultats devraient permettre de mieux comprendre le virus SARS-CoV-2 et ses mutations, qui restent un sujet de préoccupation pour les mois qui viennent, et les autres coronavirus, et ainsi renforcer nos connaissances pour limiter une future émergence.
Premières leçons et perspectives
La pandémie Covid-19 n’est pas encore terminée et les efforts de recherche et de découverte de nouveaux instruments de lutte doivent se poursuivre. Par exemple, des essais cliniques sont prévus pour l’anticorps monoclonal développé avec la société Spikimm (voir les avancées des applications de la recherche). La pandémie nous rappelle également que les épidémies de cette ampleur existent et ne sont pas à reléguer dans les livres d’histoire. Elle confirme le potentiel épidémique des virus respiratoires, ce qui devrait orienter notre vigilance. Elle invite, au-delà de la seule communauté scientifique, à trouver des moyens de lutter contre les facteurs d’émergences, notamment le changement climatique et les contacts animal-Homme.
Cette pandémie a également souligné le besoin de renforcer les moyens d’action de l’Institut Pasteur en réponse aux émergences, particulièrement dans le domaine de la vaccinologie. Ce sera un enjeu important pour les prochaines années. Côté scientifique, les chercheurs sont restés très connectés, échangeant en temps réel sur les connaissances scientifiques, en complément des publications scientifiques via des pré-publications commentées sur des réseaux sociaux comme Twitter. Mais cette information scientifique brute mise à disposition sur le net – par essence complexe et nécessitant d’être vérifiée par les pairs –, a nécessité une attention soutenue pour maintenir sa qualité au service de la santé globale.
Avec Arnaud Fontanet, responsable à l’Institut Pasteur de l’unité d’Épidémiologie des maladies émergentes et co-responsable de l’axe Maladies infectieuses émergentes (Plan stratégique 2019-2023).
- Connaître la biologie du virus via l’ingénierie génétique
- Comprendre le Covid-long
- Étudier l’interaction du virus avec les cellules ciblées via l’imagerie structurale
- Étudier l’infection par SARS-CoV-2, via l’imagerie chez l’animal
- Étudier l’interaction du virus avec les cellules de l’hôte
- Développer des stratégies thérapeutiques
- Étudier la réponse immunologique à l’infection et au vaccin
Shigellose, profil d’une émergence
La shigellose est une maladie diarrhéique, endémique dans plusieurs régions du monde et causant également des épidémies dès lors que des populations sont rassemblées dans un environnement où les conditions d’hygiène sont défaillantes.
Cette maladie est le fait d’une bactérie intestinale pathogène dont l’homme est le seul réservoir. Son potentiel infectieux est très important : 10 à 100 bacilles suffisent à provoquer la maladie. L’émergence de souches résistantes aux antibiotiques et la morbidité liée aux conséquences à long terme dues à des infections récurrentes la placent sous haute surveillance.
Origines et émergences
- Bactéries Shigella, clones spécialisés de l’espèce Escherichia coli, découvertes en 1897 par le bactériologiste Kyoshi Shiga.
- 4 sérogroupes : Shigella dysenteriae, Shigella flexneri, Shigella boydii et Shigella sonnei. S. sonnei est le plus fréquent en France (70 % des cas) et en phase d’émergence mondialement. S. flexneri est responsable de 2/3 des shigelloses en Afrique et en Asie.
Transmission
Voie oro-fécale via l’eau, les aliments souillés par des déjections infectées ou par des mouches, accompagnée d’une transmission par le malade à son entourage.
Surveillance
L’Institut Pasteur est chargé de la surveillance des cas de shigellose en France (métropole et Outre-Mer), à travers l’unité des bactéries pathogènes entériques désignée comme centre national de référence (CNR) des Escherichia coli, Shigella et Salmonella.
Développements
- Vaccin : essai clinique de phase I réussi en 2021 pour un candidat-vaccin conjugué issu de sucres de synthèse, développé par l’Institut Pasteur (unité de Chimie des biomolécules / unité de Phatogénie microbienne moléculaire) contre le sérotype prévalent de S. flexneri (voir les avancées du département biologie structurale et chimie). Essai clinique de phase 2a, en cours au Kenya, pour établir l’efficacité et l’innocuité de ce candidat-vaccin monovalent dans la population cible, à savoir les très jeunes enfants. Résultats attendus courant 2023.
- Identification : mise à jour des méthodes d’identification et de typage des Shigella grâce à une approche basée sur le séquençage du génome bactérien (unité bactéries pathogènes entériques de l’Institut Pasteur).
- Diagnostic : développement de bandelettes permettant un diagnostic en 15 minutes (Pasteur Network et Service de Santé des Armées).
ACTU 2022 - Shigella : procédé BPF pour un candidat vaccin de l’Institut Pasteur
L’homme, l’environnement, l’animal, les maladies

L’épidémie de covid-19 nous a contraint de revenir à l’évidence : la vie est unique. Ce concept de « santé globale » est développé dans le monde entier, à l’OMS (Organisation mondiale de la Santé) comme à l’Institut Pasteur. Si l’environnement va mal, comment les animaux peuvent-ils aller bien ? Et, à l’intérieur du monde animal, comment pourrions-nous être les seuls à demeurer en bonne santé ? Comment préserver l’océan si nous continuons de jeter dans les fleuves nos ordures ? L’idée de frontières étanches entre les partenaires du vivant est fausse, et peut être meurtrière. Quand la vie est attaquée, c’est que d’autres êtres vivants avaient intérêt à cette attaque. Voilà l’un des héritages de Louis Pasteur, et sans doute le premier.
Avant Pasteur, la médecine était surtout faite d’observations. Grâce à lui et à d’autres, nous avons avancé dans la découverte des causes. Ce qui est frappant, c’est de voir que les responsables des maladies infectieuses qui causent la mort sont de minuscules êtres… vivants, voire des particules inertes encore plus petites, composées d’un simple génome (ADN ou ARN) et d’une enveloppe – les virus. Cette crise nous renvoie à notre fragilité. Plus le monde est relié, plus nous dépendons de ce qui paraît le plus insignifiant. Nous sommes beaucoup plus dépendants du plus faible que du plus fort. C’est par le plus faible qu’arrivent les menaces. Après avoir travaillé sur la « géopolitique des moustiques », puis sur la peste porcine, je commence à connaître un peu mieux la mécanique des épidémies. Allons-nous savoir tirer des leçons de cette nouvelle crise sanitaire ?
Cette crise nous renvoie également à notre mode de vie. La production de notre alimentation est particulièrement impliquée dans les émergences récentes. Depuis longtemps l’agriculture me passionne, en particulier ses transitions nécessaires. Notre alimentation est confrontée à une incroyable pression qui conduit à payer toujours moins cher. Le budget réservé à la nourriture dans la consommation des ménages est passé en peu de temps de 30 % à 10 %. Certains pays, comme la Chine, réorganisent leur production avec de véritables villes d’élevage, des productions industrielles avec des unités de 28 000 truies sur neuf étages. Comment penser une seconde que de tels systèmes garantissent notre sécurité sanitaire ?
Crise sanitaire, crise climatique : même combat. Les crises sont liées, comme dans la vie. Chaque année, les parasites transportés par les moustiques causent plus de 700 000 morts. Et nous nous en moquons parce que cela touche principalement les pays pauvres. Loin de moi l’idée de sacraliser le temps jadis. La mondialisation a sorti de la misère des centaines de milliers d’êtres humains mais a connu, aussi, des épidémies terribles. Notre chance serait d’admettre de devoir changer.
Unité de la vie, globalité de l’économie, connexion planétaire... Comment concilier ces rassemblements avec une société de plus en plus inégalitaire ? Et plus frappe une crise, plus durement elle frappe les plus démunis. Un immense chantier nous fait face. Avec un élan, nous pouvons retrouver la maîtrise de notre futur. Les solutions existent : elles sont, toutes, filles de la Recherche. Qui sera assez fou pour en couper les budgets ?
Propos tirés du « tract de crise » d’Erik Orsenna, éditions Gallimard, mars 2020. Texte écrit par l’auteur à partir d’un entretien avec Fabrice Moyon pour Ouest France, 21 mars 2020, puis adapté pour ce rapport annuel en avril 2022.